Современный уровень развития медицины, благодаря техническим ресурсам, позволяет раскрыть новые молекулярные основы патогенеза различных состояний. С этих позиций востребовано применение новых подходов к изучению синдрома инсулинорезистентности (СИР) или метаболического синдрома, сахарного диабета, артериальной гипертензии (АГ), ожирения, являющихся ведущими факторами риска гестационных и перинатальных осложнений [1–3].
Важнейшую роль в ауторегуляции процессов накопления и расхода энергии играет инсулин и инсулинорезистентность (ИР) [4, 5]. Последняя сопровождает нас на всех этапах жизни и реализуется во многих физиологических процессах – цикле «сон-бодрствование», менструальном цикле, репарации тканей и, что особенно важно, во время беременности [6]. Важной функцией беременности является энергопластическое обеспечение развивающегося плода, и ключевым регулятором данной функции является ИР, индуцирующая молекулярные сигнальные пути перенаправления энергии путем ограничения поступления питательных субстратов в клетки организма беременной, при этом «сэкономленная» энергия обеспечивает рост и развитие плода [7, 8].
В последние десятилетия клиницисты все чаще начали отмечать патологический характер ИР, обусловленный влиянием факторов риска, связанных с образом жизни и питания, вредными привычками, экологией, эпигенетическими нарушениями, что и привело к росту частоты дисметаболических заболеваний [1, 9, 10]. Патологическая ИР играет ключевую роль в нарушении антенатального программирования метаболических процессов, выступает ведущей причиной в развитии сахарного диабета 2 типа, ожирения, и, что особенно важно, эндотелиальной дисфункции при эссенциальной АГ и СИР [4, 11]. Следует отметить, что дисфункция эндотелия является также хорошо изученным патогенетическим механизмом преэклампсии (ПЭ), определяющим ее клинические проявления [12, 13]. Однако вопрос: «Что приводит к гестационному эндотелиозу, каковы его причины и механизмы?» до сих пор остается камнем преткновения в акушерстве. Поэтому, учитывая возникающие при беременности изменения, схожие по своей направленности с СИР [6], связь дисметаболических механизмов с формированием эндотелиальной дисфункции при эссенциальной АГ, актуальным является определение места и роли метаболических нарушений в патогенезе ПЭ.
Цель исследования: pазработка концепции формирования ПЭ на основе выявленной клинико-лабораторной общности ПЭ и СИР.
Материалы и методы
На базе Перинатального центра Самарской областной клинической больницы им. В.Д. Середавина проведено проспективное исследование с участием 292 женщин, среди которых 180 имели повышенный риск ПЭ (наличие независимых факторов риска: ПЭ в акушерском анамнезе – 72 женщины (40,0%), в семейном анамнезе – 71 (39,4%), первобеременные старшего репродуктивного возраста (>35 лет) – 37 (20,6%) наблюдений), 82 женщины с СИР и 30 женщин с неосложненным течением гестации. Ретроспективно, в зависимости от реализации ПЭ, пациентки были распределены на группы: в группу 1 вошли 89 женщин с реализовавшейся ПЭ, в группу 2 – 50 женщин с СИР и реализовавшейся ПЭ, группу 3 составили 32 беременные с СИР без реализации ПЭ, группа 4 (контрольная) была представлена 30 беременными с физиологически протекающей беременностью.
Критерии включения в группу 1: реализация ПЭ у женщин с независимыми факторами риска, определяемые до беременности уровень АД менее 130 и 85 мм рт.ст., индекс массы тела от 18,5 до 24,9 кг/м2, отсутствие метаболических нарушений. Для выявления женщин с СИР использовались критерии Международной федерации диабета (2005), также зарегистрированные на догестационном этапе (в качестве обязательного критерия учитывалась окружность талии, как проявление висцерального ожирения, и два дополнительных из следующих – концентрация триглицеридов (ТГ), липопротеидов высокой плотности (ЛПВП), уровень АД). Для нивелирования влияния исходной гипергликемии на процессы гестационных изменений плазменная концентрация глюкозы венозной крови у женщин с СИР была <6,1 ммоль/л. Для всех групп критериями исключения явились: прегравидарные нарушения углеводного обмена, соматическая (кроме СИР в группах 2 и 3), инфекционная и аутоиммунная патология, гестационный диабет, СПКЯ, пороки развития плода и половых органов беременной, индуцированная беременность, нарушение протокола обследования в динамике беременности.
Обследование женщин проводилось в 11–14, 18–21, 30–34 недель беременности и в период манифестации ПЭ и включало оценку метаболических показателей (глюкоза венозной крови, ЛПВП, ТГ, мочевая кислота, расчет индексов ИР (HOMA-IR) и ТГ/ЛПВП), гормонов (лептин, инсулин, плацентарный лактоген (ПЛ)), маркеров протромботического (агрегация тромбоцитов, средний объем тромбоцита) и провоспалительного (фактор некроза опухоли-α (ФНО-α), индекс активации лейкоцитов (ИАЛ)) статусов, дестабилизации сосудистого эндотелия (десквамированные эндотелиальные клетки (ДЭК), метаболиты оксида азота (NO)), плацентарного α-микроглобулина-1 (ПАМГ-1), фактора роста плаценты (ФРП). Клиническое обследование заключалось в определении типов динамики АД в течение суток, особенностей отложения жировой ткани, субъективной оценке характеристик сна и периодов гестационного сонного апноэ.
В ходе лабораторно-инструментальной диагностики были использованы анализаторы Sysmex XN-1000 (Sysmex Corporation, Япония), АЛАТ-2 (ООО НПФ «Биола», Россия), Architect c4000, Architect i1000 SR (Abbotte, США), ультразвуковая система Voluson E6 GE Healthcare (GE, США). Для оценки типа суточного профиля АД применена автоматическая система BP-Lab («Петр Телегин», Россия). Субъективную оценку характеристик сна проводили согласно рекомендациям Я.И. Левина (1995) [14]. Периоды сонного апноэ диагностировались аппаратом кардиореспираторного мониторинга сна SomnoCheck (Weinmann, Германия). По методу K. Tayama et al. (1999) оценивали распределение жировой ткани: толщину преперитонеального (тППЖ) и подкожного (тПКЖ) жира. Проводился расчет индекса жира брюшной стенки (ИЖБС=тППЖ/тПКЖ, значение>1,0 свидетельствует о висцеральном типе жироотложения брюшной стенки) [15]. Диагностика ПЭ осуществлялась согласно рекомендациям клинического протокола [16]. Оценка степени тяжести плацентарной недостаточности проводилась с учетом рекомендаций А.Н. Стрижакова с соавт. (2014) [17].
Статистический анализ
Статистический анализ проведен с применением специализированной программы IBM SPSS Statistics 25 HC IMAGO 5.0 (IBM, США), с соблюдением рекомендаций для медицинских и биологических исследований. Нормальность распределения показателей оценивалась по критерию Шапиро–Уилка. Описательная статистика для количественных признаков, распределение которых отличалось от нормального, представлена медианой (Ме) и межквартельным размахом от Q1 (25% квартиль) до Q3 (75% квартиль). Сравнение независимых выборок проводили с применением U-критерия Манна–Уитни. Для сравнения номинальных признаков использован χ² Пирсона, при размерности таблицы сопряженности 2×2 – χ² Пирсона с поправкой Йейтса. Зависимые выборки (динамика показателя во время беременности) сравнивались по W-критерию Уилкоксона. Корреляционный анализ Спирмена использовался для оценки взаимосвязей между показателями.
Результаты и обсуждение
Системный взгляд на проблему ПЭ позволяет отметить выраженное клиническое сходство данной патологии с СИР, причем оно касается как основных критериев ПЭ – АГ и протеинурии, так и циркадианных изменений уровня АД, проявлений синдрома обструктивного апноэ сна, инсомнии, особенностей отложения жировой ткани (табл. 1). Выбор данных клинических проявлений связан с тем, что они имеют характерную специфику при СИР [9, 18, 19], которая была выявлена и при ПЭ. Патологические типы вариабельности АД, характеризующиеся повышением давления в ночные часы (найт-пикер) или недостаточным его снижением (<10% по сравнению со средним дневным уровнем, нон-диппер) в ночное время, встречались не только в группах 2 и 3 женщин с СИР, но и у 53,9% женщин группы 1 – с ПЭ (р<0,05).
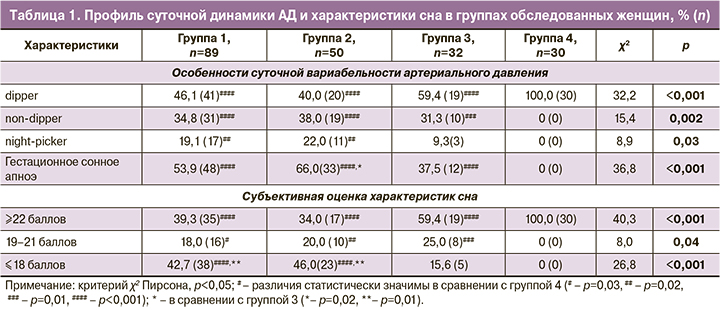
Синдром обструктивного апноэ сна является отдельным клинико-патогенетическим вариантом СИР и характеризуется потенцирующими ИР оксидативным стрессом и повышением уровня катехоламинов в ночное время в периоды гипоксемии и гипоксии [19, 20]. Подобные нарушения функции дыхания у беременных женщин, обозначаемые термином гестационное сонное апноэ, имеют место в 53,9% при ПЭ без сочетания с экстрагенитальной патологией, в 66,0% и 37,5% наблюдений в группах 2 и 3 (χ21-2=1,92, р1-2=0,17; χ21-3=2,54, р1-3=0,11; χ22-3=6,40, р2-3=0,01). С повышением АД и периодами сонного апноэ в ночное время также связана описанная при СИР инсомния, которая характеризуется плохим качеством ночного сна, негативными сновидениями, дневной сонливостью и встречается у женщин с ПЭ в 42,7% наблюдений в группе 1 и 46,0% – в группе 2, что отражает общность нарушений центральных механизмов при ПЭ и СИР.
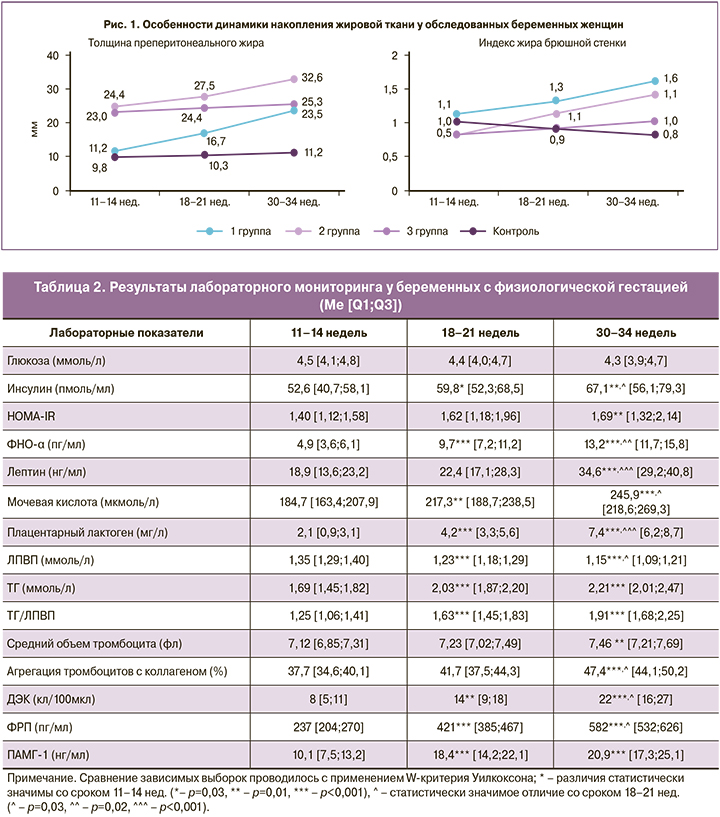
Интересными у беременных с ПЭ представляются результаты анализа отложения жировой ткани, объем и функциональная активность которой определяют ведущие критерии СИР в большинстве существующих международных рекомендаций [9]. Так, данные динамического ультразвукового исследования показали, что у женщин с ПЭ увеличение количества жировой ткани происходит в основном за счет преперитонеального (висцерального) жира. Представленные на рисунке 1 изменения наглядно отражают статистически значимый рост тППЖ в динамике гестации в 2,1 и 1,3 раза соответственно в 1 и 2 группах (р<0,001), а также динамику ИЖБС, показатель которого >1,0 свидетельствует о висцеральном типе жироотложения брюшной стенки. Это подтверждает общую закономерность в распределении жировой ткани, как при СИР, так и при ПЭ – с преобладанием висцерального жира.
При этом не вызывает никакого сомнения, что клиническая схожесть ПЭ и СИР имеет под собой патогенетически обусловленную основу. Об этом свидетельствует и частота клинической реализации ПЭ, которая имела место у 49,4% (89/180) женщин в группе с независимыми факторами риска, а в группе с СИР достигала 61,0% (50/82) [χ2=2,56, р=0,11]. Такая высокая частота реализации ПЭ и ее сопоставимость в сравниваемых группах, несомненно, отражает схожесть патогенеза СИР и ПЭ.
Анализируя закономерности становления физиологической гестации, было отмечено, что уже в самой «норме беременности» заложены изменения, свойственные СИР. Для организма женщины во время беременности характерно переключение клеточного энергообеспечения с углеводного компонента – глюкозы, на жировой, что в процессе естественного отбора закреплено для создания наиболее благоприятных условий роста и развития плода [6, 7]. Согласно полученным данным (табл. 2), физиологическую гестацию сопровождает статистически значимое нарастание HOMA-IR, уровня инсулина, показателей липидного профиля (р<0,05 для всех показателей), которое свидетельствует о диабетогенном и атерогенном сдвиге метаболизма с формированием физиологических ИР и гиперинсулинемии (ГИ), что согласуется с данными литературы [8]. Это указывает на схожесть физиологической беременности с функциональной фазой метаболического синдрома [21]. Выявленный в контрольной группе метаболический паттерн, а также умеренное провоспалительное и гиперкоагуляционное состояния, активация эндотелиально-тромбоцитарного звена при срыве перманентных механизмов адаптации могут превышать физиологический характер нарастания с реализацией в структурные нарушения и выступать предпосылками развития ПЭ.
Результаты лабораторного мониторинга у беременных с ПЭ и с СИР показали выраженное сходство по всем оцениваемым параметрам (рис. 2). ИР и ГИ – ключевые составляющие СИР, значимо нарастали у женщин с ПЭ уже с I триместра беременности по сравнению с контролем, приобретая патологический характер (р<0,001). Высокую интенсивность атерогенных и гиперурикемических сдвигов при ПЭ, приобретающих альтеративный характер и свойственных СИР, отражает динамика липидных показателей и содержание мочевой кислоты (р<0,001). Уровень глюкозы крови во всех группах не выходил за границы референсных значений, что обусловлено выбранными критериями включения и исключения (р>0,05).

Преэклампсия, как и СИР, сопровождается выраженным контринсулярным сдвигом гормонального профиля, создаваемым плацентой для формирования ИР с целью энергообеспечения развивающегося плода. Концентрация ПЛ, оказывающего наиболее выраженное контринсулярное действие из плацентарных гормонов, у беременных с ПЭ в динамике гестации значительно выше, чем у женщин 3-й и контрольной групп (группа 1 – 5,7 [4,1;7,0], 9,3 [7,6;10,2] и 12,5 [11,2;13,4] мг/л; группа 2 – 7,5 [6,3;8,9], 11,7 [10,4;13,1] и 14,6 [13,6;15,3] мг/л; группа 3 – 2,5 [1,4;3,7], 4,8 [3,9;6,0] и 7,9 [6,5;9,1] мг/л соответственно в 11–14, 18–21 и 30–34 недель гестации, р1-3, p1-4, р2-3, p2-4<0,001 на каждом сроке обследования), что определяет патологическое нарастание уровней ИР и ГИ. Уровень лептина, играющего существенную роль в патогенезе СИР и тесно связанного с ИР [22], также имел наибольшее нарастание в группах с ПЭ (группа 1 – 32,5 [25,8;36,4], 62,4 [56,4;69,6], 83,9 [76,3;88,1] нг/мл; группа 2 – 46,7 [41,1;54,8], 77,6 [72,3;81,4], 86,2 [81,9;92,3] нг/мл; группа 3 – 41,4 [37,6;50,1], 48,3 [41,2;54,1], 59,8 [51,3;67,7] нг/мл соответственно в 11–14, 18–21 и 30–34 недель гестации, р1-3, p1-4, р2-3, p2-4<0,001 на каждом сроке обследования).
Широко известно, что при СИР в организме развивается состояние низкоинтенсивного хронического воспаления, которое поддерживается синтезом в жировой ткани ФНО-α – важнейшего медиатора воспаления и ИР [23]. У беременных с ПЭ также выявлено значимое нарастание ФНО-α по сравнению с контрольной группой на всех сроках гестации (p<0,001) (рис. 3). Динамика ИАЛ, характеризующего функциональную активность лейкоцитов, показала схожие изменения, чем также подтверждается формирование иммунометаболических нарушений при ПЭ и СИР. К лабораторным особенностям СИР относится формирование протромботического состояния, причем результаты исследования выявили схожие изменения у беременных с ПЭ и с СИР, которые заключаются в увеличении среднего объема тромбоцита за счет молодых и активированных форм, повышении агрегационной активности тромбоцитов. У беременных с ПЭ и СИР, по сравнению с контролем, нами выявлены статистически значимо более низкие уровни ФРП, который относится к одному из белков семейства фактора роста эндотелия сосудов. При этом согласно данным литературы, при СИР вне беременности описывается аналогичный дефицит указанных факторов, что указывает на схожие антиангиогенные изменения при ПЭ и СИР [24].
В пользу общности механизмов формирования АГ при ПЭ и СИР свидетельствуют данные о статистически значимом снижении концентрации метаболитов NO у беременных групп 1, 2 и 3 по сравнению с контролем. Причем динамика показателя указывает на детерминированность нарушений синтеза NO во II и III триместрах нарастанием патологических ИР и ГИ. Помимо снижения метаболитов NO прямым показателем, отражающим морфофункциональное повреждение эндотелиоцитов сосудистой стенки, являются десквамированные эпителиальные клетки. Необходимо отметить, что у беременных с ПЭ и СИР выявлено схожее нарастание количества ДЭК, превышающее значения контроля (р<0,001).
Динамика исследованных показателей и результаты корреляционного анализа указывают на первичность дисметаболических процессов, связанных с патологическими ИР и ГИ, относительно других, более поздних, звеньев патогенеза ПЭ. Между значениями концентрации гормона инсулина, индекса ИР и содержанием ФНО-α (k=0,83; k=0,85, при р<0,001), ДЭК (k=0,86; k=0,89, при р<0,001), агрегацией тромбоцитов (k=0,81; k=0,87, при р<0,001), тППЖ (k=0,85; k=0,89, при р<0,001) получена сильная ассоциативная положительная связь, а с концентрацией метаболитов NO (k=-0,81; k=-0,88, при р<0,001), ФРП (k=-0,87; k=-0,92, при р<0,001) – сильная отрицательная связь. Также выявлена положительная ассоциативная связь средней силы между уровнями инсулина, HOMA-IR и концентрацией мочевой кислоты (k=0,69; k=0,70, при р<0,05).
Следовательно, выявленные клинико-лабораторные параллели, отражающие общность динамики патогенетически значимых лабораторных показателей с реализацией в схожие клинические проявления ПЭ и СИР, свидетельствуют о том, что ПЭ формируется по общим с СИР механизмам, при которых ИР запускается либо жировой тканью – при СИР, либо плацентой – при ПЭ.
Крайне актуальным продолжает оставаться вопрос патогенетической гетерогенности ранней и поздней ПЭ. При этом отмечаемые на популяционном уровне различия по своей сути обусловлены лишь скоростью манифестации единых клинических проявлений – АГ и протеинурии, а также частотой развивающихся осложнений, которые маскируют патофизиологические изменения, свойственные непосредственно ПЭ [25–27]. Проведенный анализ результатов обследования женщин с ранней и поздней неосложненной ПЭ из группы с независимыми факторами риска (группа 1) позволил объективизировать клинико-лабораторные особенности разных сроков реализации ПЭ. Анализ клинико-лабораторных особенностей неосложненных ранней и поздней ПЭ показал отсутствие значимых различий по частоте реализации осложнений, связанных с функционированием эмбрио(фето)плацентарного комплекса, при прослеживающейся тенденции превалирования данных осложнений среди женщин с ранней ПЭ (табл. 3). Можно заключить, что патология маточно-плацентарно-плодового комплекса – угроза прерывания беременности, плацентарной недостаточности различной степени тяжести, преждевременные роды – не имеет специфической и первостепенной роли в механизмах развития только ранней ПЭ.

Анализ распределения особенностей циркадианного профиля АД, субъективных характеристик сна у женщин с ранней и поздней ПЭ также не показал значимых различий (р>0,05).
При ранней и поздней неосложненной ПЭ нами не выявлено различий по большинству исследованных маркеров (р>0,05), что указывает на одинаковую вовлеченность патологических ИР и ГИ и связанных с ними нарушений в механизмы развития как ранней, так и поздней ПЭ (рис. 4). Это свидетельствует об отсутствии базовой патогенетической гетерогенности ПЭ различных сроков клинической манифестации.
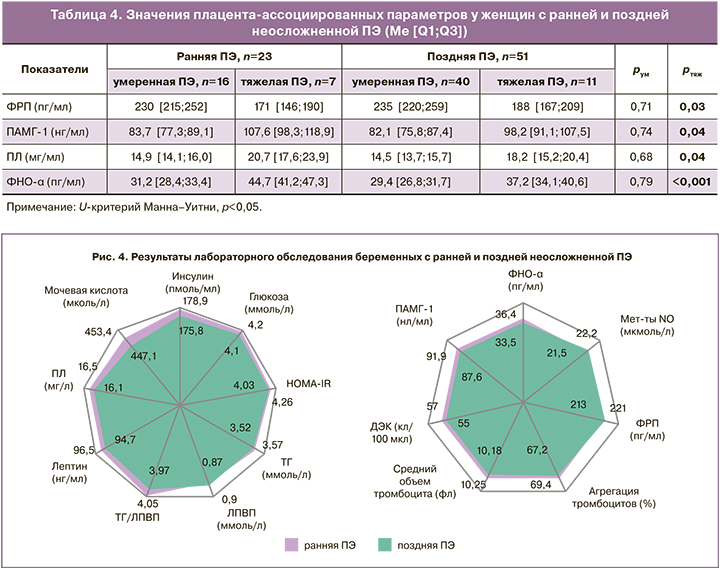
В то же время выявлено статистически значимое преобладание по ряду плацента-ассоциированных параметров при ранней тяжелой ПЭ на фоне отмечаемой тенденции к развитию более тяжелых форм плацентарной недостаточности (табл. 4). Данный факт подтверждает, что дисфункция фетоплацентарной системы в качестве дополнительного дестабилизирующего фактора, наряду с догравидарными и периконцепционными нарушениями, девиациями генных сетей и эпигенетическими механизмами, иммунными реакциями ускоряет развитие и нарастание единых базовых механизмов в виде патологической ИР и ГИ, что и определяет индивидуальный срок манифестации ПЭ [28, 29].
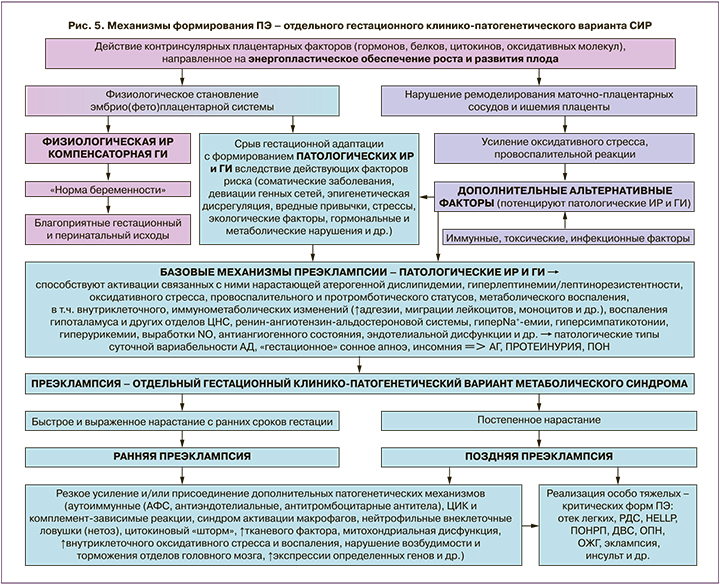
Следовательно, представленные аргументы, подтверждающие клинико-лабораторную тождественность ПЭ и СИР, позволяют рассматривать ПЭ в качестве отдельного гестационного клинико-патогенетического варианта СИР, базовые механизмы которого являются едиными и универсальными вне зависимости от срока клинической манифестации ПЭ. Обобщенная схема разработанной научной концепции отражена на рисунке 5. Нарастание патологических ИР и ГИ с ранних сроков гестации определяет направленность патологических изменений при беременности высокого риска с реализацией гестационной АГ, протеинурии, полиорганной недостаточности.
Заключение
Полученные данные позволили сформировать новый взгляд на патогенез преэклампсии, при этом предпосылки ее формирования заложены в закономерностях развития физиологической беременности. Срыв гестационной адаптации к контринсулярным факторам плаценты приводит к выраженному нарастанию физиологических сдвигов c трансформацией в патогенетические звенья ПЭ. Патофизиологическими механизмами развития ПЭ, как и СИР, выступают патологические ИР, ГИ, реализующие свое действие через вторично ассоциированные с ними дислипидемию атерогенного характера, гиперлептинемию и гиперурикемию, метавоспаление и иммунометаболические нарушения, оксидативный стресс, протромботический статус, антиангиогенное состояние, которые приводят к структурно-функциональной дестабилизации сосудистого эндотелия, выступающей лишь верхушкой айсберга в цепи патогенетических событий ПЭ и реализующейся в симптомокомплекс АГ, протеинурии и полиорганной недостаточности.
Наличие дополнительных повреждающих факторов, таких как плацентарная ишемия, иммунные, инфекционные, токсические, девиации генных сетей, эпигенетическая дисрегуляция, потенцирует базовые механизмы патогенеза, что определяет срок клинической манифестации ПЭ.
Реализация осложненной тяжелой ПЭ, по-видимому, связана с резким усилением или присоединением дополнительных патогенетических механизмов: развитием, так называемого, цитокинового шторма, антифосфолипидного синдрома, нарастанием эндотелиальной дисфункции, комплемент-зависимых и иммунокомплексных реакций, активацией лейкоцитарных ловушек (нетоз), митохондриальной дисфункции и внутриклеточного оксидативного стресса, воспаления ЦНС и др.
Полученные нами результаты доказывают общность патогенетических механизмов ПЭ и метаболического синдрома, что позволяет рассматривать данное осложнение беременности в качестве отдельного клинико-патогенетического варианта СИР.
Беременность, как мощнейший стрессовый фактор, демаскирует скрытые нарушения, связанные с фенотипическими особенностями энергообеспечения организма, в частности с ИР, что ведет к их клинической реализации в виде ПЭ, гестационного сахарного диабета. Окончание периода беременности не приводит к полному регрессу активированного патологического процесса, сохранение которого определяет столь высокую частоту реализации кардио-васкулярно-метаболических нарушений у женщин с ПЭ на последующих этапах жизни, причин летальных исходов, аналогичных СИР.
Таким образом, взгляд на формирование ПЭ как клинико-патогенетический вариант СИР объясняет ее клиническую и патогенетическую вариабельность, определяет возможность разработки новых диагностических и прогностических маркеров для снижения материнской и перинатальной заболеваемости.



