Врожденный иммунитет, главными эффекторными клетками которого являются нейтрофильные гранулоциты и моноциты, играет важную роль в защите организма новорожденного от патогенов. Бактериальные инфекции в раннем неонатальном периоде приводят к возникновению серьезных заболеваний и являются одной из основных причин неонатальной и младенческой смертности. Повышенная восприимчивость недоношенных новорожденных к возникновению инфекционной патологии обусловлена многими факторами, в том числе низкой функциональной активностью эффекторных звеньев их иммунной системы [1].
Макрофаги/моноциты и полиморфноядерные фагоциты выступают в качестве первой линии защиты организма от инфекционных агентов, осуществляя фагоцитоз и привлекая впоследствии более специфические факторы адаптивного иммунитета. Активация фагоцитов реализуется через мембранные FcR- и CR-рецепторы [2]. Процесс фагоцитоза индуцирует генерацию и высвобождение кислородных радикалов, осуществляющих, наряду с ферментами гранул, бактерицидную функцию [3]. Кроме того, активированные моноциты и нейтрофилы синтезируют молекулы, способствующие созреванию, дифференцировке, активации эффекторных клеток адаптивного иммунного ответа [4].
При преждевременном рождении ребенка повышается его восприимчивость к инфекционным заболеваниям в связи с наличием дефицита ряда факторов иммунной системы [5]. На сегодняшний день имеется мало сведений о различиях в субпопуляционном составе лейкоцитов пуповинной и периферической крови новорожденных в зависимости от гестационного срока и наличия инфекции. Недостаточно представлены данные, характеризующие особенности экспрессии поверхностных рецепторов на фагоцитах и способность генерировать активные формы кислорода (АФК) клетками пуповинной и периферической крови недоношенных новорожденных в раннем неонатальном периоде.
Целью данной работы стало определение особенностей субпопуляционного состава и функциональной активности лейкоцитов пуповинной и периферической крови у детей при рождении и в раннем неонатальном периоде в зависимости от гестационного возраста и врожденной инфекционной патологии.
Материал и методы исследования
Исследовались образцы пуповинной крови 51 ребенка, рожденного путем операции кесарева сечения в ФГБУ НЦАГиП им. В.И. Кулакова в 2013–2014 году. Родители новорожденных детей подписывали информированное согласие на проведение обследования. Все дети в зависимости от гестационного возраста были разделены на 2 группы: I – доношенные дети (n=8) и II – недоношенные (n=43). В группу доношенных вошли только здоровые дети. Группа недоношенных детей была разделена на две подгруппы: новорожденные без признаков инфекции (IIа, n=19) и новорожденные, у которых были выявлены инфекционные заболевания (IIб, n=24). У недоношенных детей отмечались дыхательные нарушения: в подгруппе IIa в качестве основного диагноза выступал респираторный дистресс-синдром, в подгруппе IIб врожденная пневмония. Диагноз устанавливался на основании рентгенологической картины легких, наличия или отсутствия изменений в клиническом анализе крови, характерных для воспаления, уровня С-реактивного белка и прокальцитонина в сыворотке крови [6]. Новорожденные дети с врожденными пороками развития, врожденным сепсисом, гемолитической болезнью новорожденных, а также рожденные от матерей, подвергавшихся иммуносупрессивной терапии, были исключены из данного исследования.
Проспективное обсервационное исследование проводилось на базе отделения реанимации и интенсивной терапии новорожденных отдела неонатологии и педиатрии ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России. В зависимости от степени дыхательных нарушений проводились различные виды респираторной поддержки. Антибактериальная терапия в первые 72 часа проводилась всем детям до установления окончательного диагноза на 3-и сутки жизни и была продолжена курсом 7–10 дней у детей с врожденной пневмонией.
 Поверхностный фенотип клеток периферической крови определяли с помощью моноклональных антител, меченных флуоресцеин-изотиоцианатом или фикоэритрином, против антигенов CD95, CD11b, CD16, CD64, CD38, HLA-DR (Becton Dickinson, США). Анализ проводили с использованием проточного цитофлуориметра FACSСalibur (Becton Dickinson, США). Гейтирование нейтрофильной и моноцитарной областей осуществляли, исходя из показателей прямого и углового светорассеяния. Оценивали процентное содержание субпопуляций клеток, а также количество рецепторов на поверхности клетки, определяя среднее геометрическое интенсивности флуоресценции (gMFI geometric mean fluorescence intensity), величину которого выражали в условных единицах. На основании общего анализа крови определяли абсолютное количество лейкоцитов каждого охарактеризованного фенотипа.
Поверхностный фенотип клеток периферической крови определяли с помощью моноклональных антител, меченных флуоресцеин-изотиоцианатом или фикоэритрином, против антигенов CD95, CD11b, CD16, CD64, CD38, HLA-DR (Becton Dickinson, США). Анализ проводили с использованием проточного цитофлуориметра FACSСalibur (Becton Dickinson, США). Гейтирование нейтрофильной и моноцитарной областей осуществляли, исходя из показателей прямого и углового светорассеяния. Оценивали процентное содержание субпопуляций клеток, а также количество рецепторов на поверхности клетки, определяя среднее геометрическое интенсивности флуоресценции (gMFI geometric mean fluorescence intensity), величину которого выражали в условных единицах. На основании общего анализа крови определяли абсолютное количество лейкоцитов каждого охарактеризованного фенотипа.
Анализ генерации АФК клетками цельной крови проводили методом люминолзависимой хемилюминесценции в присутствии ионов Са2+ на приборе Хемилюм-2001 (Россия), используя в качестве индукторов форбол-12-миристат-13-ацетат (ФМА, 5×10-7М), N-формил-L-метионил-L-лейцил-L-фенилаланин (фМЛФ, 5×10-5 М), опсонизированный сывороткой крови взрослых доноров зимозан (ОЗ, 0,25 мг/мл). Интенсивность процесса оценивали, принимая во внимание величину амплитуды индуцированного сигнала.
Для сопоставления фенотипа фагоцитарных клеток и их функциональной активности при рождении ребенка и в раннем неонатальном периоде, у 33 недоношенных детей (14 – из подгруппы IIa и 19 – из подгруппы IIб) кроме пуповинной крови производился забор периферической крови на 3–5-е сутки жизни.
Статистическая обработка данных проводилась общепринятыми методами вариационной статистики с использованием пакетов статистического анализа для Microsoft Office Excel 2010. Соответствие расчетных выборок показателей нормальному распределению оценивали с помощью критерия Колмогорова–Смирнова с использованием статистического пакета MedCalc12 для Windows 7. Результаты представлены как среднее значение по выборке ± ошибка среднего. Выявление корреляционных связей осуществлялось, исходя из показателей коэффициента корреляции Пирсона.
Результаты исследования и обсуждение
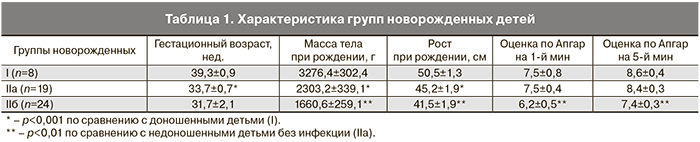
Клинические данные, характеризующие группы новорожденных детей, представлены в табл. 1. Инфицированные недоношенные дети отличались более низкими показателями массы, роста, оценки по шкале Апгар на 1-й и 5-й минутах по сравнению с недоношенными новорожденными без инфекции (табл. 1).
При анализе содержания нейтрофилов (6,8±2,2×109/л в I группе, 8,4±2,7×109/л во IIа и 5,8±1,9×109/л во IIб подгруппах, р>0,05) и моноцитов (1,3±0,5х109/л в I группе, 1,9±1,2×109/л во IIа и 1,2±0,3×109/л во IIб подгруппе, р>0,05) в пуповинной крови обследованных новорожденных детей достоверных различий выявлено не было.
Иммунофенотипирование фагоцитов пуповинной крови обследуемых групп новорожденных не выявило существенных различий в содержании клеток, несущих маркеры CD95 (Fas-антиген, свидетельствующий о готовности клетки к апоптозу), CD11b (рецептор для С3-фрагмента комплемента), СD16 (низкоафинный рецептор FcγRIII для IgG) и CD64 (высокоафинный рецептор FcγRI для IgG). С целью выявления зависимости абсолютного содержания CD16+-, CD11b+- и CD64+-нейтрофилов в пуповинной крови новорожденных без инфекции (группы I и IIa) от гестационного возраста определяли коэффициент корреляции Пирсона (r). Он составил 0,61; 0,61; 0,63 (p<0,05) соответственно. Это свидетельствует о зависимости содержания нейтрофильных гранулоцитов, несущих перечисленные маркеры, от срока гестации.
Плотность экспрессии рецептора CD11b на нейтрофилах и моноцитах пуповинной крови недоношенных детей (IIа) оказалась ниже по сравнению с группой доношенных (I): 280,6±81,4 gMFI против 492,0±173,3 gMFI (р=0,03) на нейтрофилах и 146,4±46,9 gMFI против 355,9±127,8 gMFI (р=0,005) на моноцитах соответственно. Напротив, экспрессия рецептора CD64 на поверхности фагоцитарных клеток пуповинной крови недоношенных новорожденных (IIa) отличалась более высокой интенсивностью по сравнению с детьми, рожденными в срок (I): 51,4±6,0 gMFI и 39,5±10,6 gMFI (р=0,04) на нейтрофилах и 438,7±84,5 gMFI и 326,7±38,7 gMFI (р=0,017) на моноцитах соответственно, что согласуется с данными, полученными другими авторами [7, 8].
В пуповинной крови недоношенных детей (IIa) по сравнению с группой доношенных детей (I) снижена доля моноцитов, экспрессирующих молекулу CD38 (95,7±1,7% и 98,6±0,4% соответственно, р=0,002), и повышено как содержание HLA-Dr+-моноцитов (94,6±1,7% и 89,7±4,7%, р=0,04), так и плотность экспрессии данной молекулы на их поверхности (226,1±42,5 gMFI и 97,5±30,5 gMFI, р=2,2×10-5). CD38 – трансмембранный гликопротеид, экспрессируемый неактивированными моноцитами. Повышение его экспрессии на поверхности клеток приводит к их активации и усилению адгезии к эндотелиальным клеткам [9]. Приведенные результаты свидетельствуют об активированном состоянии моноцитов в пуповинной крови неинфицированных недоношенных детей (IIa) по сравнению с детьми, рожденными в срок (I).
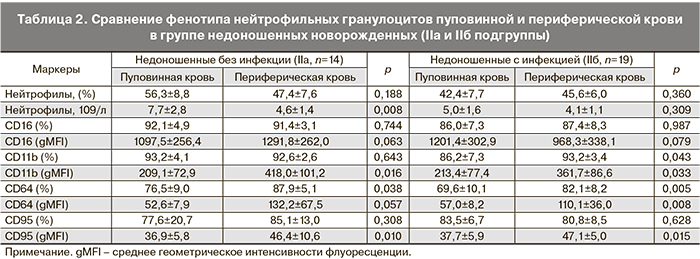
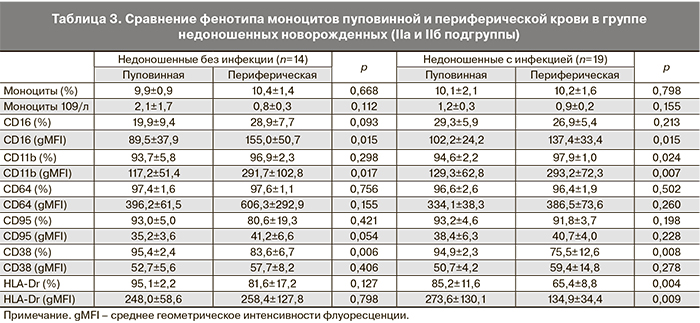
Анализ субпопуляций фагоцитов как пуповинной, так и периферической крови недоношенных новорожденных IIa и IIб подгрупп не выявил различий между ними в содержании клеток, экспрессирующих определяемые в данном исследовании рецепторы и интенсивности их поверхностной экспрессии.
В табл. 2 и 3 представлены различия в экспрессии CD-маркеров на поверхности фагоцитарных клеток периферической крови по сравнению с пуповинной в группах недоношенных новорожденных с проявлениями внутриутробной инфекции (IIa) и без таковой (IIб). При фенотипировании нейтрофилов периферической крови детей на 3–5-е сутки после рождения установлено, что к этому сроку у недоношенных детей, независимо от наличия инфекционной патологии, увеличивается содержание CD64+-клеток, возрастает интенсивность поверхностной экспрессии молекул CD95 и CD11b. При наличии инфекции возрастает интенсивность экспрессии рецептора CD64 и повышается относительное содержание CD11b+-нейтрофилов. Таким образом, в раннем неонатальном периоде для гранулоцитов характерно увеличение интенсивности экспрессии активационных маркеров, что свидетельствует об активном развитии врожденного иммунитета недоношенных детей в этот период (табл. 2).
 Фенотипирование моноцитов периферической крови новорожденных на 3–5-е сутки после рождения выявило усиление экспрессии CD16 и CD11b рецепторов в течение первых дней жизни. В группе инфицированных новорожденных увеличивается доля CD11b+-, но существенно снижается относительное содержание CD38+- и HLA-Dr+-моноцитов и плотность экспрессии HLA-Dr на поверхности клеток по сравнению с пуповинной кровью, что может быть обусловлено истощением пула моноцитов при активации механизмов иммунной защиты новорожденных, подвергавшихся внутриутробному воздействию патогенов. Значимых различий по содержанию CD64+-моноцитов и плотности экспрессии этого высоко аффинного рецептора к Fc-фрагменту IgG между подгруппами IIa и IIб недоношенных новорожденных не было выявлено (табл. 3).
Фенотипирование моноцитов периферической крови новорожденных на 3–5-е сутки после рождения выявило усиление экспрессии CD16 и CD11b рецепторов в течение первых дней жизни. В группе инфицированных новорожденных увеличивается доля CD11b+-, но существенно снижается относительное содержание CD38+- и HLA-Dr+-моноцитов и плотность экспрессии HLA-Dr на поверхности клеток по сравнению с пуповинной кровью, что может быть обусловлено истощением пула моноцитов при активации механизмов иммунной защиты новорожденных, подвергавшихся внутриутробному воздействию патогенов. Значимых различий по содержанию CD64+-моноцитов и плотности экспрессии этого высоко аффинного рецептора к Fc-фрагменту IgG между подгруппами IIa и IIб недоношенных новорожденных не было выявлено (табл. 3).
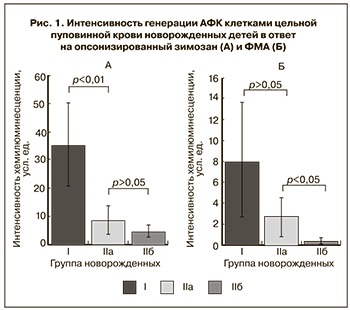
Результаты оценки функциональной активности фагоцитов пуповинной крови новорожденных представлены на рис. 1–3. При стимуляции клеток цельной пуповинной крови ОЗ (рис. 1А), происходящей с участием рецепторов для комплемента, иммуноглобулинов и молекул, входящих в состав углевода зимозана, генерация АФК клетками пуповинной крови недоношенных новорожденных детей (IIa) была существенно ниже по сравнению с группой доношенных детей (I) (8,8±5,0 усл. ед. против 35,5±14,6 усл. ед., р<0,01). При активации образцов крови ФМА – неспецифическим активатором протеинкиназы С – наблюдалось достоверное снижение индуцированной хемилюминесценции в пуповинной крови инфицированных недоношенных новорожденных (IIб) относительно детей, родившихся без проявления симптомов врожденного инфекционного заболевания (IIa) (0,4±0,3 усл. ед. и 2,7±1,9 усл. ед. соответственно, р=0,023) (рис. 1Б).
Иммунная система недоношенных новорожденных характеризуется незрелостью, фагоцитарные клетки пуповинной крови обладают менее выраженной способностью к хемотаксису, сниженной поглотительной активностью, ослабленными бактерицидными свойствами. При воздействии патогенов пул фагоцитов быстро истощается, что приводит к повышению содержания в крови незрелых клеток и, как следствие этого, к еще более выраженному ослаблению функциональных свойств нейтрофилов и моноцитов [3].
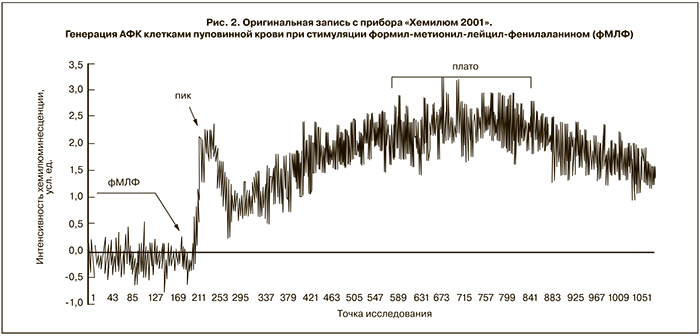
В ответ на воздействие фМЛФ – пептида бактериальной клеточной стенки – на кинетической кривой наблюдалось два всплеска: первый в виде пика в течение 1–2 мин после введения стимула в реакционную смесь, второй – в виде плавного подъема, выходящего на плато, спустя 10–15 мин после добавления активатора (рис. 2).
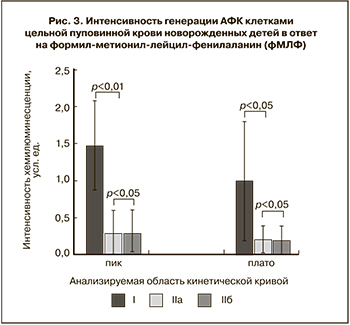
Для оценки интенсивности ответа на получение активационного сигнала через специфический рецептор к фМЛФ проводился сравнительный анализ интенсивности хемилюминесценции во время обоих всплесков. Показано, что клетки пуповинной крови здоровых доношенных новорожденных детей (I) отличались более высокой интенсивностью генерации АФК в первые минуты после индукции по сравнению с группой недоношенных детей (IIa) (рис. 3).
Предположительно высота пика зависит от состояния NADPH-оксидазы, а выход реакции на плато может быть связан с включением альтернативных путей генерации АФК, наиболее вероятный из которых – активация миелопероксидазы. Кроме того, характер ответа на фМЛФ может быть связан с разной степенью экспрессии на поверхности клеток высоко- и низко аффинных рецепторов к данному пептиду [10].
Полученные результаты согласуются с литературными данными, свидетельствующими о том, что интенсивность генерации АФК клетками пуповинной крови недоношенных новорожденных в ответ на стимулы снижена по сравнению с ответом АФК-продуцирующих клеток детей, рожденных в срок [11, 12].
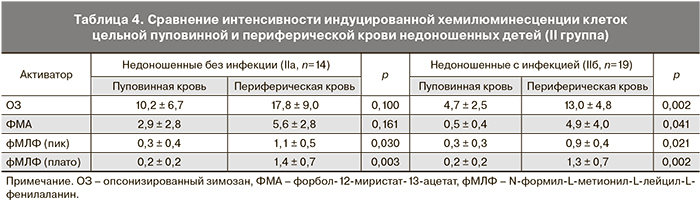
При сравнении функциональной активности фагоцитарных клеток пуповинной и периферической крови одних и тех же недоношенных детей (II группа) было выявлено увеличение уровня генерации АФК в ответ на все стимулы на 3–5-е сутки жизни, что свидетельствует о повышении функциональной активности фагоцитов в раннем неонатальном периоде. Однако достоверное усиление продукции АФК клетками периферической крови в ответ на ОЗ и ФМА наблюдалось лишь в подгруппе инфицированных детей (IIб), что может свидетельствовать о более стремительном развитии врожденного иммунитета детей, подвергавшихся воздействию патогена в процессе внутриутробного развития (табл. 4).
Заключение
Выявлена зависимость содержания активированных фагоцитов и их способности продуцировать АФК от срока гестации. Показано, что наличие инфекционной патологии не отражается на экспрессии выявляемых дифференцировочных маркеров фагоцитами пуповинной крови, однако влияет на функциональную активность АФК-продуцирующих клеток. Для раннего неонатального периода характерно увеличение интенсивности экспрессии активационных маркеров на гранулоцитах и повышение функциональной активности клеток, что свидетельствует об активном развитии врожденного иммунитета недоношенных детей в первые дни жизни. Показано, что врожденный иммунитет недоношенных детей при внутриутробном инфицировании развивается более стремительно по сравнению с неинфицированными детьми, однако при этом имеет место истощение пула моноцитов при активации механизмов иммунной защиты новорожденных, подвергавшихся внутриутробному воздействию патогенов.



