Известно, что интенсивное развитие вспомогательных репродуктивных технологий (ВРТ) не привело к значительному повышению эффективности лечения бесплодия в программе экстракорпорального оплодотворения (ЭКО). Частота наступления беременности на попытку ЭКО во всех странах мира остается одинаково стабильной на протяжении многих лет и не превышает 30–40% [1]. Клиническая практика показывает, что около 50% эмбрионов, полученных в результате проведения программ ЭКО, оказываются неполноценными, не пригодными для переноса, а у определенной группы пациенток вообще не удается получить качественные эмбрионы, что негативно сказывается на результатах лечения [2, 3].
Общемировая тенденция к увеличению доли пациенток позднего репродуктивного возраста, желающих иметь детей, приводит к ряду проблем, включающих среди прочего ухудшение компетентности ооцитов, от которых напрямую зависит протекание процессов оплодотворения, эмбриогенеза и имплантации эмбриона в полости матки.
Было показано, что ооциты пациенток старшего возраста характеризуются нарушениями деятельности митохондриального комплекса (и связанными с этим аномалиями веретена деления) [4], повышенной частотой встречаемости хрупкости митохондриальных мембран [5, 6] и общим истощением метаболических ресурсов цитоплазмы [7, 8], а также различными цитоплазматическими аномалиями (вакуоли, сегрегации гладкого эндоплазматического ретикулума) [5, 6]. Все перечисленное приводит к нарушениям процессов развития эмбрионов in vitro, более частой остановке на стадии дробления, отсутствию или недостаточному количеству бластоцист, пригодных для переноса [9].
Цитоплазматическая фрагментация является одной из распространенных аномалий развития эмбриона и с большей вероятностью связана с низким качеством ооцитов, чем с повреждениями ДНК сперматозоидов [10].
Фрагментацию эмбрионов связывают с нарушением деления бластомеров и в целом с повреждением цитоскелета клетки [11]. Есть мнение ряда специалистов, указывающих на то, что метаболизм высокоплотных белков может иметь значение в развитии фрагментации эмбрионов [12].
Перспективной для дальнейшего изучения является точка зрения ученых, утверждающих, что ведущим механизмом, приводящим к остановке развития эмбриона, являются процессы апоптоза, происходящие в его клетках [13]. Было показано, что апоптотические процессы в бластомерах не запускаются до момента компактизации, когда дозревает митохондриальный аппарат и формируются тесные взаимодействия между клетками, а сигналы апоптоза могут не только генерироваться в одном бластомере, но и через gap junction передаваться соседним клеткам. Более того, в период раннего эмбриогенеза (1–3-й дни развития) дробление эмбриона осуществляется в основном за счет метаболитов, белков и информационной РНК, накопленных в процессе созревания ооцита, а включение в процесс транскрипции белков и активация собственного генома и метаболизма эмбриона происходят непосредственно перед началом процесса компактизации [13].
По данным ряда авторов, от 48 до 70% остановившихся в развитии эмбрионов обнаруживали значительные хромосомные аномалии, и большинство этих хромосомных аномалий возникли в процессе I деления мейоза, то есть в процессе оогенеза [13].
Таким образом, в большей мере на остановку развития эмбрионов влияет предопределенность, закладываемая на стадии одной клетки, то есть зиготы, чем внешние факторы среды, которые могут влиять на качество эмбрионов, но не на продолжение или остановку его развития [14]
Возможным решением проблемы, востребованной клинической практикой, представляется полная замена дисфункционального цитопласта ооцита с помощью переноса генетического материала пациента (на стадии полового пузырька, в виде веретена деления на стадии метафазы II или 2 пронуклеусов после успешного оплодотворения) в предварительно энуклеированный донорский ооцит.
Представленная методика имеет объективную аргументацию для преодоления блока эмбриогенеза, наблюдающегося у некоторых бесплодных пар, проходящих программу ЭКО, [14], а также, возможно, повысит результаты лечения бесплодия у женщин старшего репродуктивного возраста за счет улучшения морфологического качества эмбрионов и количества получаемых бластоцист.
Цель исследования: разработать методику переноса ядра из ооцита реципиента в энуклеированный ооцит донора и оценить перспективы развития реконструированного эмбриона.
Задачи исследования.
1. Отработать методику переноса генетического материала из одной зиготы в другую, предварительно энуклеированную, зиготу.
2. Оценить влияние методики реконструкции зигот на дальнейшее развитие эмбриона.
Материалы и методы
В основу исследования легла работа Hyslop L.A. et al. (2016), в которой авторы представили методику переноса пронуклеусов при митохондриальном заболевании [15].
Обоснованиями для переноса пронуклеусов явились следующие аргументы.
1. Не требуется синхронизации между ядрами и донорским цитопластом.
2. Есть возможность отработки методики на триплоидных зиготах (3PN) как свежих, так и криоконсервированных эмбрионов.
3. Не требуется дополнительного оснащения в лаборатории ЭКО.
В процессе отработки методики переноса ядер использовали следующие реагенты и материалы.
1. Цитохалазин В (Sigma Aldrich,1mg CCB/vial, C-6762).
2. Сендай вирус (HVJ-Envelope Cell Fusion Kit).
3. Среда для биопсии эмбрионов (Origio, Cooper Surgical).
4. Культуральное масло Mineral Oil (Sage, Cooper Surgical).
5. Среда для культивирования: Early Cleavage и Blast Assist (СООК).
6. Стриппер и капилляры для манипуляций с эмбрионами d 300мкм (COOK).
7. Пипетка-холдинг для удержания ооцита во время манипуляций, 30 мкм внутренний диаметр (Humagen, Cooper Surgical).
8. Пипетка для биопсии: 17–25 мкм внутренний диаметр (Humagen, Cooper Surgical).
9. 4-луночный планшет для культивирования (NUNC).
10. Пробирка 14 мл (NUNC).
11. Чашка ICSI (NUNC).
12. Инвертированный микроскоп Nicon с системой микроманипуляторов Narishige и лазерной системой OctaxNaviLase (Германия).
13. Инкубатор для культивирования эмбрионов (Planer Origio).
14. Ламинарный шкаф с подогреваемой поверхностью (Fortuna IVF Origio).
Методику переноса ядер отрабатывали на аномально оплодотворившихся ооцитах (3PN), не пригодных для дальнейшего использования в программе ВРТ и подлежащих утилизации. Было использовано 28 триплоидных зигот. Проведено 14 процедур переноса ядер.
Триплоидные зиготы помещали в раствор цитохалазина В на 8 минут в инкубатор с 6% СО2, затем зиготы перемещали в среду для биопсии и, удерживая с помощью холдинг-пипетки, проводили процесс энуклеации (рис. 1–4).
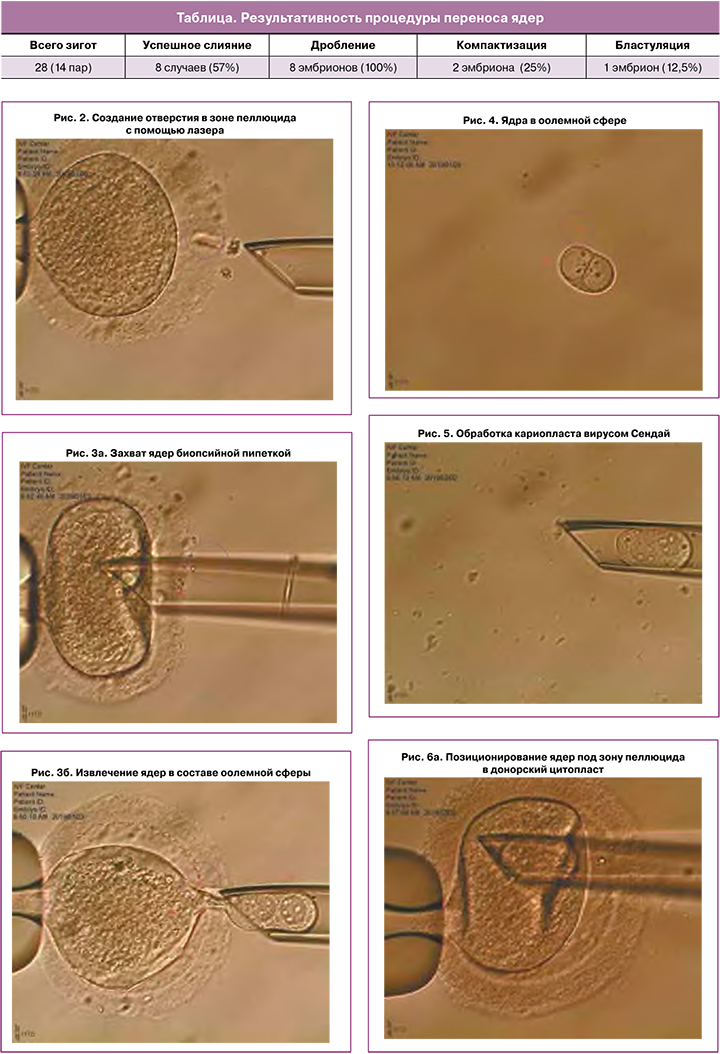
Один из полученных кариопластов, состоящий из двух поздних пронуклеусов, пипетировали в растворе вируса HVJ-E (рис. 5) и затем помещали в энуклеированный цитопласт другой зиготы (донорский цитопласт) (рис. 6).
После чего реконструированную зиготу и энуклеированный цитопласт (в качестве контроля) помещали в культуральную среду и культивировали до 5-х суток, производя смену среды на 3-и сутки развития.
Результаты
После проведения процедуры переноса ядер и помещения их в перивителлиновое пространство донорского цитопласта происходило слияние кариопласта с оолеммой цитопласта. Затем пара пронуклеусов самопроизвольно перемещались в центр зиготы (рис. 7) В дальнейшем происходил стандартный процесс дробления эмбриона.
В результате проведения процедуры переноса успешное слияние перенесенных ядер с энуклеированным цитопластом имело место в 57%, дегенерация наступила в 43% случаев. У всех 8 успешно реконструированных зигот наблюдалось дробление с различной степенью фрагментации (10–70%), однако процент компактизации и бластуляции был снижен (таблица), в результате нами были получены один эмбрион на стадии морулы и один эмбрион на стадии бластоцисты (таблица, рис. 8).
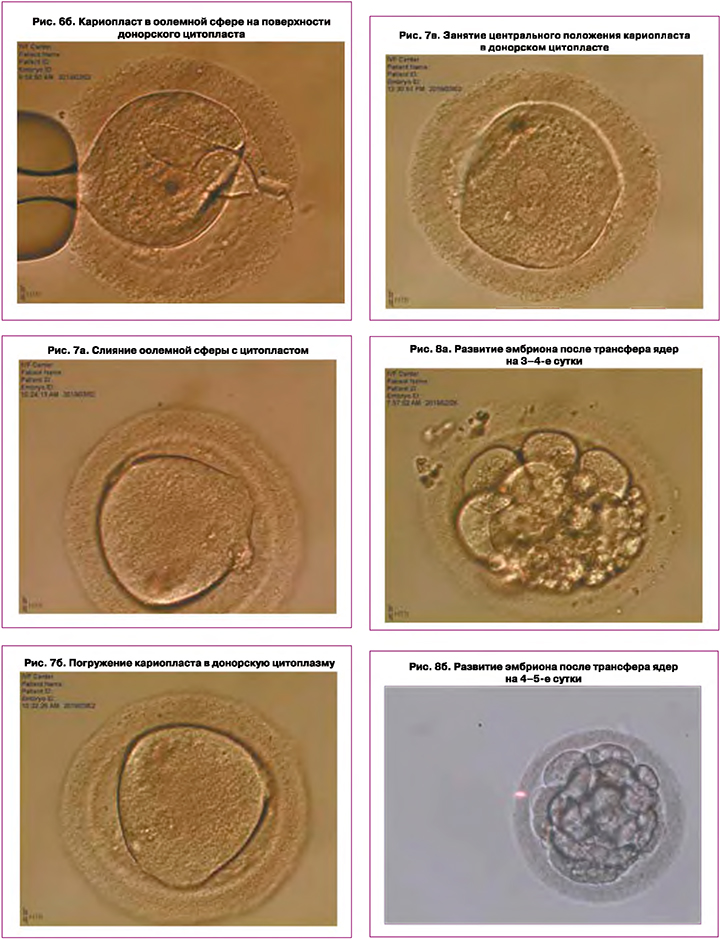
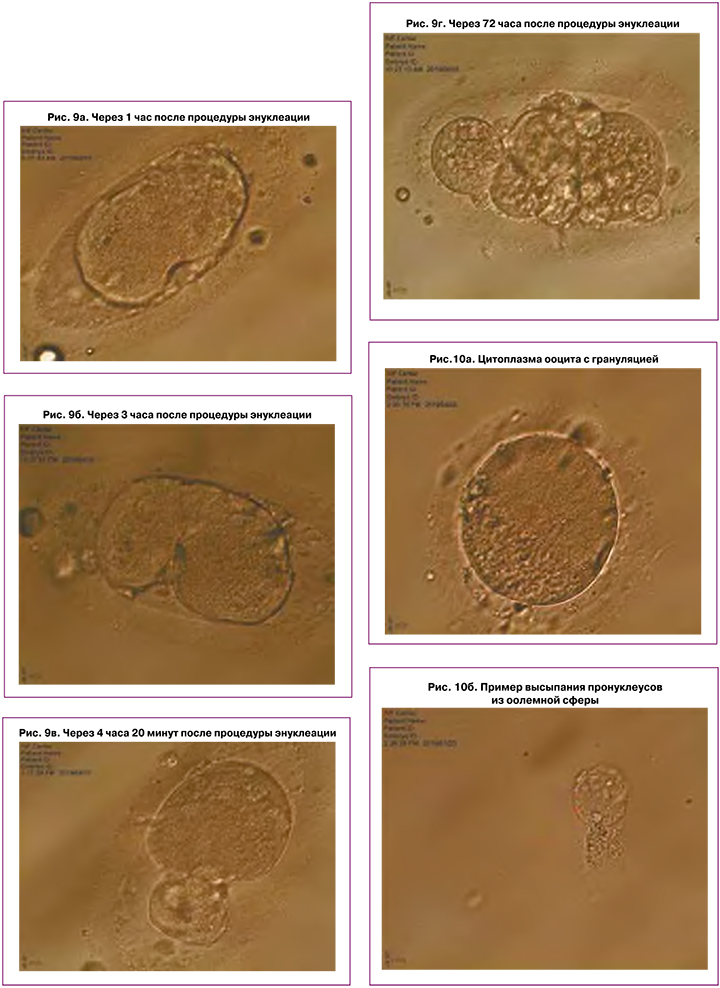
Характерным явился тот факт, что энуклеированный донорский цитопласт также начинал дробиться, однако на стадии 4–8 бластомеров происходила остановка развития (рис. 9).
Результаты проведенной работы показали, что критическим моментом в осуществлении процесса извлечения ядра является качество цитоплазмы. При наличии грануляции, вакуолизации, потемнения цитоплазмы, нарушении вязкости оолемы, неравномерной плотности невозможно извлечь ядра в оолемной сфере, что приводит к высыпанию отдельных ядер и прерыванию процедуры (рис. 10).
Обсуждение
Представленный эксперимент показал возможность проведения процедуры переноса ядра из одной клетки в другую. Определены необходимое материальное обеспечение, рабочие растворы, и эффективность вируса HVJ-E в обеспечении слияния мембран клеток оценена как вполне приемлемая.
При переносе генетического материала на стадии пронуклеусов происходит захватывание некоторого количества цитоплазмы, что в нашем случае отрицательно сказалось на дальнейшем дроблении эмбриона, снижая частоту бластуляции, поскольку при процедуре энуклеации вместе с цитоплазмой, вероятнее всего, теряются важные факторы, необходимые для успешного репрограммирования ядра и нормального прохождения последующих после активации собственного генома эмбриона этапов эмбриогенеза [16].
С другой стороны, зарегистрированный нами феномен продолжающегося дробления энуклеированной клетки до стадии 4–8 бластомеров бесспорно подтверждает данные о том, что в период раннего эмбриогенеза (1–3-и сутки развития) дробление эмбриона осуществляется в основном за счет метаболитов, белков и информационной РНК, накопленных в процессе созревания ооцита, и активация собственного генома эмбриона происходит непосредственно перед началом компактизации [17].
Анализ полученных нами результатов показал, что успешность переноса ядер зависит от состояния цитоплазмы клетки; различные аномалии цитоплазмы приводят к невозможности проведения процедуры энуклеации вследствие неспособности дефектной цитоплазмы к формированию полноценного нуклеопласта. Следовательно, процедура переноса ядер возможна только при использовании зигот без явно выраженных дисморфизмов как со стороны донора, так и реципиента ядер.
Таким образом, несмотря на то, что методика переноса генетического материала на стадии пронуклеусов является вполне успешной, необходима дополнительная ее отработка с возможной модификацией. Также нам представляется целесообразной отработка методики переноса генетического материала на других стадиях развития (например, в виде веретена деления на стадии метафазы II).
Выводы
1. Существует реальная техническая возможность переноса генетического материала из одной клетки в другую с целью улучшения ее компетентности при использовании ооцитов генетически разных пациенток.
2. Процедура переноса ядер, возможно, влияет на потенциал дальнейшего развития эмбриона, снижая частоту бластуляции.
3. Перенос зиготы на стадии пронуклеусов возможен только при отсутствии дефектов цитоплазмы ооцита как донора, так и реципиента
4. Необходимы продолжение исследований и разработка других методик, например, перенос веретена деления.



