Бедный и субоптимальный ответ яичников на стимуляцию в программах экстракорпорального оплодотворения (ЭКО) у женщин репродуктивного возраста является актуальной проблемой современной репродуктологии. Пациентки со сниженными показателями овариального резерва составляют 24–48% всех пациенток, подвергающихся стимуляции функции яичников в программах вспомогательных репродуктивных технологий [1]. Отсутствие ооцитов при трансвагинальной пункции яичников является частым явлением у данного контингента женщин [2–4], что оказывает огромную психологическую нагрузку на пациентку.
Результаты научных исследований показывают, что малые антральные фолликулы в течение лютеиновой фазы менструального цикла не в обязательном порядке уходят в атрезию, а скорее находятся на ранних стадиях фолликулярного развития [5–7]. Этот факт ставит под сомнение традиционную теорию развития когорты антральных фолликулов только во время фолликулярной фазы цикла [5]; появляется все больше доказательств, указывающих на наличие нескольких волн антральных фолликулов, развивающихся в одном и том же менструальном цикле женщины [8, 9].
«Волновая теория» развития фолликулов в яичниках стала основой для проведения стимуляции суперовуляции не только в фолликулярной, но и в лютеиновой фазе цикла у женщин со сниженным овариальным резервом [10]. На сегодняшний день такой подход к лечению данного контингента женщин является предметом изучения, также вызывает интерес динамика концентраций половых гормонов в крови при проведении двойной индукции суперовуляции.
Цель исследования: изучить эффективность протоколов стимуляции функции яичников в фолликулярную и лютеиновую фазы менструального цикла у пациенток со снижением овариального резерва.
Материал и методы исследования
На базе отделения сохранения и восстановления репродуктивной функции и лаборатории эндокринологии ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России проведено проспективное рандомизированное исследование. В исследование были включены 148 пациенток, соответствовавшие критериям включения (возраст 25–42 года; уровень антимюллерова гормона (АМГ) <1,2 нг/мл, базальная концентрация фолликулостимулирующего гормона (ФСГ) >11 и <20 мМЕ/мл; наличие в анамнезе безуспешных циклов ЭКО/интрацитоплазматической инъекции сперматозоида (ИКСИ); индекс массы тела (ИМТ) от 18 до 29 включительно). Критериями исключения были: эндометриоз III–IV степени распространения, пороки развития половых органов, патозооспермия III–IV степени и др.
Все пациентки проходили лечение бесплодия в программе ЭКО и были разделены на две группы с учетом фазы, во время которой проводилась стимуляция яичников: I группа (n=72) – стимуляция суперовуляции проведена только в фолликулярной фазе, II группа (n=76) – проведена двойная стимуляция функции яичников (в фолликулярную (подгруппа IIa) и в лютеиновую фазу (IIб) одного менструального цикла). Распределение пациенток по группам проводилось методом случайных чисел.
Подбор стартовой дозы осуществлялся индивидуально, исходя из возраста женщины и параметров овариального резерва. Пациенткам I группы со 2-го дня менструального цикла и до дня введения триггера овуляции вводили индивидуально подобранную дозу рекомбинантного ФСГ от 150 до 225 МЕ в сутки и/или человеческого менопаузального гонадотропина 75–150 МЕ в сутки. При достижении фолликулами диаметра 14 мм для предотвращения преждевременного пика лютеинизирующего гормона (ЛГ) в крови пациенткам вводился антагонист гонадотропин-рилизинг-гормона (ГнРГ) (цетротид 0,25 мг). Триггер овуляции (трипторелин 0,2 мг) вводили при наличии в яичниках по данным ультразвукового исследования (УЗИ) ≥2 фолликулов диаметром более 17 мм. Трансвагинальная пункция яичников (ТВП) выполнялась через 35–36 часов после введения триггера овуляции. Поддержка лютеиновой фазы индуцированного цикла у пациенток проводилась с использованием микронизированного прогестерона в дозе 600 мг/день (утрожестан) с первых суток после ТВП в течение 10 дней.
Пациенты II группы подвергались двойной стимуляции функции яичников. Введение гонадотропинов в фолликулярную фазу осуществлялась аналогично таковой в I группе, затем, через 3–4 дня после первой ТВП, начинали стимуляцию суперовуляции в лютеиновую фазу цикла. Критерием начала стимуляции было наличие в каждом яичнике двух и более антральных фолликулов 3–8 мм в диаметре. Пациенткам вводили индивидуально подобранную дозу рекомбинантного ФСГ от 150 до 225 МЕ в сутки и/или человеческого менопаузального гонадотропина 75–150 МЕ в сутки. Препараты антагониста ГнРГ не применялись. Для предотвращения менструально-подобной реакции назначали норэтистерон в дозе 10 мг с момента достижения доминантными фолликулами 13 мм и до дня введения триггера овуляции. Триггер овуляции (трипторелин 0,2 мг) вводили при наличии в яичниках по данным УЗИ ≥2 фолликулов диаметром ≥17 мм. Вторая ТВП выполнялась через 35–36 часов после введения триггера овуляции.
Взятие периферической крови для определения концентраций ЛГ, эстрадиола и прогестерона осуществляли на 2-й день цикла, 6-й день стимуляции, в день введения триггера овуляции, день ТВП; концентрацию ФСГ в сыворотке крови определяли на 2-й день цикла и в день проведения ТВП. Полученный материал центрифугировали в течение 10 мин при 3000 об./мин в холодовой центрифуге. Содержание ФСГ, ЛГ, эстрадиола и прогестерона в образцах сыворотки крови определяли методом твердофазного иммунохемилюминесцентного анализа на анализаторе IMMULITE 2000 с использованием тест-систем: FSH, LH, Estradiol, Progesterone (Siemens, США).
Оплодотворение ооцитов проводилось только методом ИКСИ. Культивирование эмбрионов происходило в индивидуальных каплях. Оценку качества эмбрионов производили согласно классификации D.K. Gardner, W.B. Schoolcraft от 1999 г. [11]. Все эмбрионы высшего качества криоконсервировались (на 3-и сутки после ТВП – эмбрионы стадии восьмиклеточного бластомера 1-й и 2-й класс, на 5-е сутки – бластоцисты только хорошей морфологии). Перенос эмбрионов производился только в «криоциклах».
Подготовка эндометрия для переноса криоконсервированных эмбрионов проводилась с помощью заместительной гормональной терапии (эстрадиола валерат в дозе 6 мг/сут с 5-го дня менструального цикла и микронизированный прогестерон в дозе 600 мг/день при достижении эндометрием 8–10 мм и четкой трехслойной структуры по данным УЗИ). Перенос размороженного эмбриона проводили на 4-й день приема прогестерона при переносе эмбриона 3 суток культивирования, либо на 6-й день – при переносе эмбриона 5 суток культивирования.
Исследование было одобрено комиссией по этике биомедицинских исследований ФГБУ НЦАГиП им. В.И. Кулакова МЗ РФ. Статистическая обработка данных выполнена при помощи пакета прикладных программ SPSS Statistics 22.0. Для оценки характера распределения количественных данных предварительно проводился тест Колмогорова–Смирнова. Учитывая нормальный тип распределения данных, результаты представлены как среднее ± стандартное отклонение в таблицах и в тексте.
Для сравнения данных применяли методы параметрической статистики: t-тест. Статистически значимыми считались различия при р<0,05. Достоверность различий в частоте встречаемости качественных признаков определяли по критерию χ2.
Результаты исследования
Все женщины, вошедшие в исследование, соответствовали критериям включения и исключения. Не обнаружено статистической разницы в возрасте и ИМТ исследуемых групп. Так, возраст пациенток в I группе составил 36,0±4,5 года, во II группе 36,7±3,8 года (р>0,05); средний ИМТ – 22,4±3,2 и 22,2±2,6 кг/м2 соответственно (р>0,05). Среднее количество неэффективных попыток ЭКО в анамнезе составило в I группе 1,6±1,3, во II группе – 1,9±1,2 (р>0,05). Не обнаружено статистически значимых различий в характеристиках овариального резерва. Так, концентрация АМГ составила 0,89±0,33 и 0,94±0,30 нг/мл (р>0,05), число антральных фолликулов – 5,5±1,5 и 5,9±2,0 (р>0,05), базальная концентрация ФСГ – 12,79±2,04 и 12,8±3,0 МЕ/мл в I и во II группе (р>0,05) соответственно.
При сравнении параметров проведенной стимуляции функции яичников не обнаружено статистической разницы в стартовой дозе гонадотропинов (252,4±71,8 МЕ в I группе, 248,7±95,7 МЕ во II группе) (t-тест, р>0,05), суммарной дозе гонадотропинов (2185,7±634,7 МЕ в I группе, 2260,5±715,2 МЕ во II группе (а и б)) (р>0,05), длительности проведенной стимуляции (9,8±1,7 МЕ в I группе, 9,6±1,3 в фолликулярной фазе двойной стимуляции II группы (р>0,05), 9,9±1,6 в лютеиновую фазу двойной стимуляции II группы (р>0,05)).
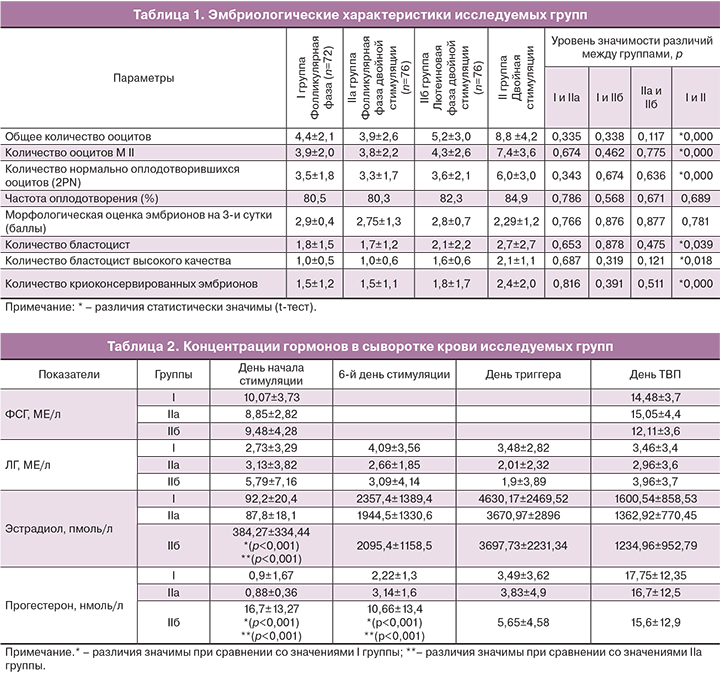
Анализ эмбриологического этапа исследуемых групп выявил статистически значимое увеличение числа полученных ооцитов, зрелых ооцитов, количества нормально оплодотворенных ооцитов и, соответственно, числа полученных эмбрионов и эмбрионов высокого качества при двойной стимуляции за счет стимуляции в лютеиновой фазе. Более подробно эмбриологические данные представлены в табл. 1.
Значения концентраций ФСГ, ЛГ, эстрадиола и прогестерона в сыворотке крови у женщин, проходивших лечение в программе ЭКО, представлены в табл. 2.
В значениях уровня ФСГ в крови в день начала стимуляции и в день ТВП яичников значимых различий в группах не было найдено (р>0,05). Статистически значимых различий в значениях уровня ЛГ на протяжении всей стимуляции функции между группами также не было выявлено (р>0,05). Отмечалось постепенное увеличение уровня сывороточного эстрадиола, сопровождающее рост фолликулов, и были найдены значимые различия в значениях гормона между группами в день начала стимуляции функции яичников (р<0,001) (табл. 2). Уровень прогестерона был значительно выше во IIб группе в день начала стимуляции функции яичников (p<0,001) и на 6-й день лечения (p<0,001), что объясняется продолжающейся гормональной активностью желтых тел. Однако ко дню введения триггера овуляции концентрации прогестерона исследуемых групп выравниваются, возможно, в связи с угасанием активности желтых тел к этому периоду; в день ТВП концентрации прогестерона также сопоставимы независимо от фазы стимуляции (табл. 2).
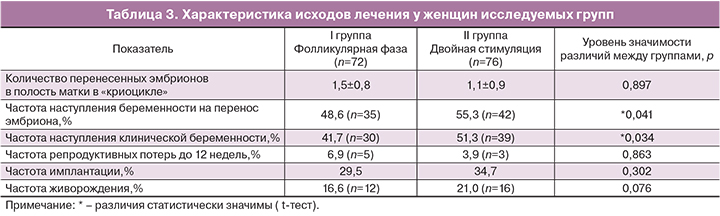
Далее была проведена оценка исходов лечения женщин исследуемых групп в программах вспомогательных репродуктивных технологий (табл. 3).
По количеству эмбрионов, перенесенных в полость матки в программе переноса размороженных эмбрионов, пациентки в исследуемых группах между собой не различались (р>0,05). Были выявлены статистически значимые различия по частоте наступления беременности на перенос эмбриона (р=0,041) и клинической беременности (р=0,034) в исследуемых группах. Частота прерывания беременности до 12 недель составила 6,9% в I группе и 3,9% во II группе (р>0,05). Частота живорождения в исследуемых группах составила 16,6 и 21,0% в I и II группах соответственно (р=0,076).
Обсуждение
Известно, что при стимуляции суперовуляции для предупреждения преждевременного выброса ЛГ используются препараты антагониста ГнРГ [12]. Однако, по данным нашего исследования, при проведении стимуляции суперовуляции в лютеиновую фазу спонтанного выброса ЛГ не происходит, несмотря на концентрацию эстрадиола, сопоставимую с таковой на 6-й день стимуляции функции яичников в фолликулярную фазу. Так, концентрация эстрадиола на 6-й день стимуляции в I группе составила 2357,4±1389,4 пмоль/л, во IIа группе – 1944,5±1330,6 пмоль/л, во IIб – 2095,4±1158,5 (р>0,05), при концентрации ЛГ в I группе – 4,09±3,56МЕ/л, во IIа группе-2,66±1,85МЕ/л, во IIб – 3,09±4,14 (р>0,05) [13]. Такие же данные представил Li-Hong Wei и соавт. в 2015 г. [14]. Они предположили, что высокие концентрации прогестерона блокируют выброс ГнРГ, что в свою очередь приводит к снижению секреции ЛГ [15]. По результатам нашего исследования концентрация прогестерона ко дню введения триггера овуляции в лютеиновую фазу значительно снижается и достигает значений, сопоставимых со значениями в I группе (концентрация прогестерона в день введения триггера в I группе – 3,49±3,62 нмоль/л, во IIб группе – 5,65±4,58 нмоль/л (p>0,05)). Однако для предотвращения менструально-подобной реакции во II группе был назначен норэтистерон 10 мг/сут., концентрация которого в сыворотке используемыми нами тест-системами не определялась. Таким образом, мы не можем опровергнуть вероятность того, что отсутствие преждевременного пика ЛГ связано с высокой концентрацией циркулирующего прогестерона. Также существует гипотеза, что отсутствие преждевременного пика ЛГ в лютеиновую фазу связано не с прогестероном, а с другими медиаторами, секретируемыми желтым телом (ингибины, фоллистатин и др.) [16].
При сравнительном анализе уровня эстрадиола в исследуемых группах была отмечена одинаковая динамика роста его концентрации, соответствовавшая овариальному ответу на введение гонадотропинов, что также согласуется с исследованием Li-Hong Wei [14].
Анализ эмбриологического этапа исследуемых групп выявил статистически достоверное увеличение числа полученных ооцитов, зрелых ооцитов, количества нормально оплодотворенных ооцитов и, соответственно, числа полученных эмбрионов и эмбрионов высокого качества при двойной стимуляции за счет стимуляции в лютеиновой фазе. Это подтверждает отсутствие влияния фазы проведения стимуляции функции яичников на эмбриологический исход программы ЭКО. Такие же результаты сообщили Y. Kuang и соавт. в 2014 г. Так, при стимуляции в лютеиновую фазу получено большее количество ооцитов, чем при стимуляции в фолликулярную фазу (3,5±3,2 и 1,7±1,0 соответственно). Но следует заметить, что суммарная доза гонадотропинов, затраченная для стимуляции в лютеиновую фазу, в этом исследовании оказалась значительно выше, чем таковая в фолликулярную (3266,4±248,9 и 1802,5±712,7 МЕ соответственно) [17].
По результатам нашей работы не выявлено негативного воздействия высоких концентраций прогестерона на качество получаемых ооцитов, что подтверждается сходным числом полученных и зрелых ооцитов при стимуляции как в фолликулярную, так и в лютеиновую фазу (средняя концентрация прогестерона в плазме крови на начало стимуляции в I группе – 0,9±1,67 нмоль/л, во IIа группе – 4,88±3,06 нмоль/л, во IIб группе – 16,7±13,27 нмоль/л; число полученных ооцитов – 4,4±2,1, 3,9±2,6 и 5,2±3,0 соответственно). Возможно, это объясняется отсутствием рецепторов к прогестерону у кумулюс-ооцитарного комплекса [18, 19].
Сравнение эффективности программ переноса криоконсервированных эмбрионов выявило достоверное увеличение частоты наступления беременности (48,6 и 55,3% в I и во II группе соответственно, p=0,041) и частоты клинической беременности при проведении двойной стимуляции функции яичников (41,7 и 51,3 % в I и во II группе соответственно, p>0,034), что подтверждает одинаковую эффективность стимуляции функции яичников как в фолликулярную, так и в лютеиновую фазы цикла.
Учитывая тенденцию к «пациент-ориентированной» медицине, стимуляция в лютеиновую фазу является решением такой проблемы, как психологический дискомфорт, возникающий у пациентки при отсутствии ооцитов после стимуляции в фолликулярную фазу в связи с отсутствием периода ожидания следующего менструального цикла. Также проведение двойной стимуляции позволяет в короткий срок собрать банк эмбрионов для последующего вступления в криопротокол или проведения преимплантационного генетического скрининга полученных эмбрионов.
Заключение
На основании полученных результатов можно сделать вывод о том, что стимуляция в лютеиновую фазу менструального цикла не влияет на эмбриологический исход программы ЭКО, в связи с чем двойная стимуляция в одном менструальном цикле приводит к получению большего количества зрелых ооцитов и эмбрионов высокого качества, что выражается в увеличении частоты наступления беременности.



