В числе факторов, осложняющих беременность, важная роль принадлежит преэклампсии (ПЭ), которая до настоящего времени продолжает оставаться одной из ведущих причин материнской и перинатальной заболеваемости и смертности [1, 2]. Число наблюдений развития ПЭ во всем мире достигает 3–8% и не имеет тенденции к снижению [3, 4]. Высокая частота различных осложнений при ПЭ, очевидно, связана с отсутствием точных знаний о патогенезе заболевания и достоверных прогностических и диагностических критериях ее развития. Ситуация осложняется тем, что это мультифакториальная патология, и существует много теорий и гипотез патогенеза ПЭ, не позволяющих их сторонникам выработать единую схему оптимальной терапии. Большая часть работ, связанных с биохимическими аспектами патогенеза ПЭ, касается вопросов эндотелиальной дисфункции, оксидативного стресса, показателей ангиогенеза и апоптоза [5]. В то же время остается мало изученной роль в этих процессах модификации таких полифункциональных молекул как белки, играющих ключевую роль во всех клеточных реакциях [6]. Для поддержания нормального профиля белков необходим баланс структурных компонентов белковых молекул, к числу которых относятся протеиногенные аминокислоты. Помимо участия в биосинтезе белков, аминокислоты служат предшественниками многих биоактивных соединений, включаются в энергетический обмен, некоторые из них выполняют самостоятельные функции, в частности, как регуляторы иммунного ответа, индукторы синтеза гормонов, активаторы пролиферативных процессов, интенсивно протекающих в фетоплацентарном комплексе, особенно на ранних стадиях гестации [7, 8]. В связи с важной метаболической ролью аминокислот, а также необходимостью поиска методов ранней доклинической диагностики ПЭ, оценка аминокислотного спектра в различных звеньях системы мать-плод может быть использована в качестве предикторного маркера данной патологии.
Важную информацию о течении беременности, состоянии плода и прогнозе состояния новорожденного дает исследование околоплодных вод. Они быстро реагируют изменением своего состава на любые отклонения, происходящие в организмах матери, плода и плаценте, которая в значительной степени является источником поступления в амниотическую жидкость питательных и энергетических компонентов [9, 10]. Следует отметить, что обменные процессы между матерью и плодом, помимо основного плацентарного обмена, происходят также с помощью параплацентарного обмена, в котором околоплодные воды играют важную роль [11]. Однако работы по изучению биохимического состава этой биологически активной среды, особенно аминокислотного спектра, немногочисленны и противоречивы [12, 13], а данные о нем при ПЭ вообще отсутствуют.
В связи с вышеизложенным, настоящая работа посвящена изучению аминокислотного состава околоплодных вод при физиологической беременности и ПЭ с целью уточнения роли выявленных нарушений в развитии данной акушерской патологии.
Материал и методы исследования
В исследование включены 64 женщины, составившие 2 группы. В 1-ю группу вошли 30 клинически здоровых женщин с неосложненным течением беременности и родов (контрольная группа); во 2-ю (основную) группу – 34 женщины, беременность которых осложнилась ПЭ средней степени в соответствии с международной классификацией болезней – МКБ-10, код О14.0. Критериями включения пациенток в основную группу являлись: возраст от 20 до 35 лет, клинические признаки ПЭ, появившиеся у обследованных женщин после 24–26 недель гестации: гипертензия (давление 140–160/90 мм рт.ст.), протеинурия (выше 0,3 г/сут., но ниже 2 г/сут.). Беременность у них завершилась родами в срок (39–40 недель). Критериями включения в контрольную группу были: физиологическое течение беременности, доношенная беременность и возраст от 20 до 35 лет. Обследованные женщины наблюдались в консультативной поликлинике Ростовского НИИ акушерства и педиатрии в рамках программы «Акушерский мониторинг».
Материалом для исследования служили околоплодные воды, взятые у каждой женщины обеих групп дважды. В 16–18 недель околоплодные воды получали путем трансабдоминального амниоцентеза. Проведение этой процедуры осуществлялось для исключения хромосомной патологии плода (Приказ Минздрава России 572н от 01.11.2012). У всех плодов женщин, взятых в исследование, был нормальный хромосомный набор. Повторный забор околоплодных вод осуществляли в 39–40 недель беременности при вскрытии плодного пузыря в первом периоде родов.
Содержание свободных аминокислот в околоплодных водах определяли на автоматическом анализаторе AAA-400 «Microtechna» (Чехия). Подготовку проб и анализ проводили согласно инструкции к прибору по стандартной программе с использованием трех натрий-цитратных буферных растворов рН 3,25; 4,25; 5,28. Идентификацию аминокислот, расчет площадей пиков и определение концентрации осуществляли по результатам анализа соответствующих стандартов («Sigma-Aldrich», США) для калибровки анализатора.
Статистическую обработку данных осуществляли с помощью лицензионного пакета программ Statistica (версия 6.0 фирмы «StatSoft Inc.»). Оценка характера распределения данных с помощью критерия Шапиро-Уилка свидетельствует об их нормальном распределении. Данные представлены в виде среднего значения (M), стандартного отклонения (SD) и 95% доверительного интервала (95% CI). Статистическую значимость различий между сравниваемыми показателями определяли по критерию Стьюдента (t-критерий) для независимых выборок, а также по c2-кртерию для сравнения категориальных переменных. Корреляционный анализ выполнен с использованием критерия Пирсона и расчетом коэффициента корреляции r. Результаты оценивали как статистически значимые при р<0,05.
Результаты исследования
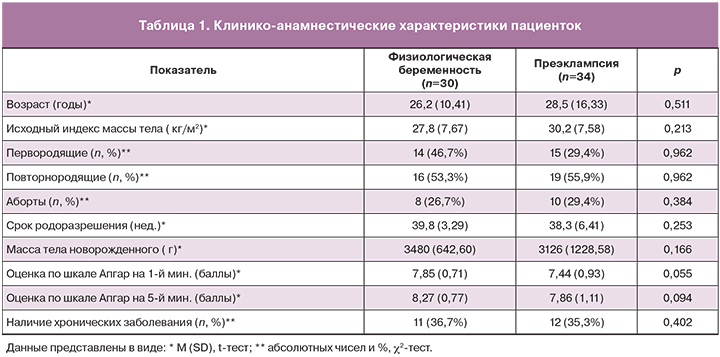
Сравниваемые группы пациенток статистически не отличались по акушерскому и соматическому анамнезу (табл. 1).
Полученные результаты свидетельствуют о том, что развитие ПЭ происходит на фоне изменений аминокислотного состава околоплодных вод по сравнению с аналогичными показателями при физиологической беременности (табл. 2, рисунок).
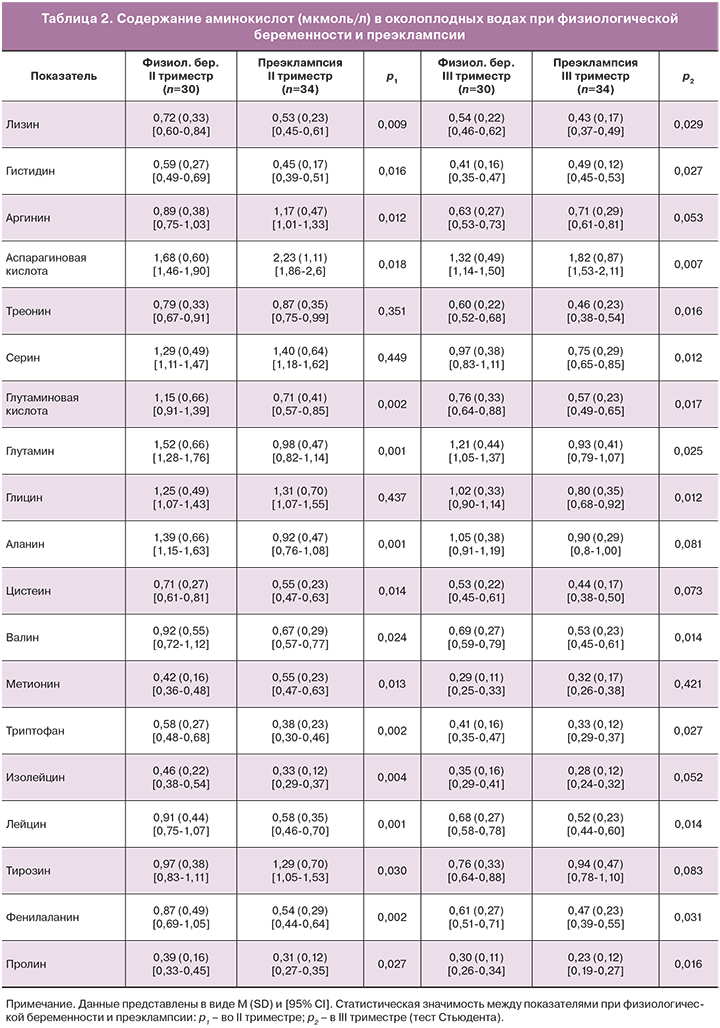
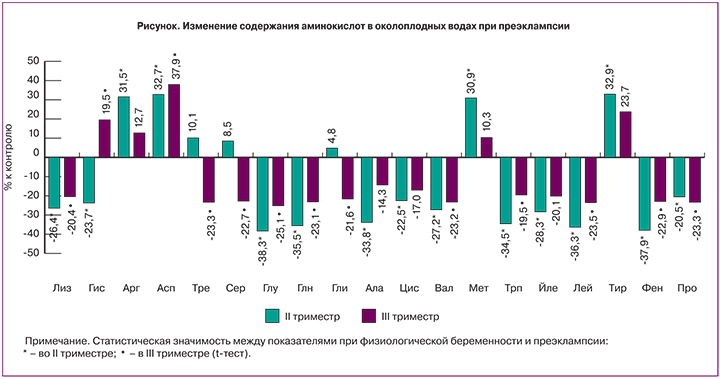
Существенная модификация содержания большинства аминокислот имеет место уже во II триместре, когда клинические признаки ПЭ еще отсутствовали. Наиболее выраженные изменения обнаружены для глутаминовой кислоты и ее амида – глутамина. Содержание этих соединений снижено на 38,3% и 35,5% соответственно. О зависимости между изменением данных показателей свидетельствует корреляционный анализ. Коэффициент корреляции (r) между ними равен +0,87 (p=0,042, 95% СI 0,84–0,9). Противоположная направленность изменения установлена для другой дикарбоновой аминокислоты – аспарагиновой, ее количество повышается при ПЭ на 31,1%. Также увеличено содержание диаминокислоты аргинина (на 31,5%) на фоне снижения содержания двух других диаминокислот – лизина (на 26,4%) и гистидина (на 23,7%). Величины большинства нейтральных аминокислот: аланина, цистеина, валина, триптофана, изолейцина, лейцина, фенилаланина и пролина в околоплодных водах во II триместре беременности при ПЭ ниже таковых в аналогичный период физиологической беременности в среднем на 30,5%. Повышенная концентрация отмечается для метионина и тирозина (на 30,9% и 32,9% соответственно). Достоверные отличия отсутствуют в содержании трех заменимых аминокислот – серина, глицина и треонина, метаболически связанных между собой.
Снижается и такой важный показатель, как отношение незаменимых аминокислот к заменимым. При физиологической беременности этот коэффициент во II триместре составляет 0,45, а при ПЭ – 0,39.
В конце беременности отклонения в аминокислотном спектре околоплодных вод менее выражены, чем во II триместре. Так, содержание глутаминовой кислоты и глутамина в III триместре при ПЭ меньше, чем при физиологической гестации, соответственно на 25,1% и 23,1%. Количество лизина снижено на 20,4%, а уровень аргинина вообще не изменялся. Для гистидина в III триместре, в отличие от II триместра имеет место повышение содержания на 19,5%. Степень уменьшения содержания пролина, фенилаланина, валина составляет 23,3%, 22,9% и 23,2% соответственно. Отсутствие достоверных отличий установлено для концентраций нейтральных аминокислот: аланина, цистеина, метионина, изолейцина и тирозина. В то же время более активное участие в развитии дисбаланса аминокислотного состава в III триместре беременности при ПЭ, очевидно, принимают серин, глицин и треонин, уровень которых понижается на 22,7%, 21,6% и 23,4% соответственно.
Обсуждение
Выявленные изменения в аминокислотном составе околоплодных вод в динамике беременности при ПЭ могут быть вызваны различными причинами, а их дисбаланс, в свою очередь, способен привести к негативным метаболическим последствиям. Среди этих причин можно отметить нарушение трансплацентарного перехода аминокислот, изменение баланса анаболизма и катаболизма белков, модификацию активности ферментов, катализирующих реакции обмена отдельных аминокислот [14].
Обращает внимание значительное изменение уровня глутаминовой и аспарагиновой кислот, являющихся интегральными показателями многих ферментативных процессов. С их участием осуществляется взаимосвязь азотистого и энергетического обменов, поэтому изменение их содержания, несомненно, влияет на состояние метаболизма в фетоплацентарной системе, в том числе на эффективность цикла трикарбоновых кислот (ЦТК). Разнонаправленные изменения концентрации глутамата и аспартата, возможно, объясняются снижением активности аспартатаминотрансферазы – одного из лимитирующих факторов в обмене аспарагиновой кислоты. Результатом этого будет ее накопление и, напротив, снижение концентрации образующейся в реакции глутаминовой кислоты. Уменьшение уровня глутаминовой кислоты может сопровождаться снижением количества глутамина при ее амидировании, что и наблюдается при ПЭ. Известно, что около 20% азота плода приходится на долю глутамина, необходимого для роста клеток плода больше, чем любая другая аминокислота [15]. Азот амидной группы глутамина важен для синтеза нуклеотидов и гексозаминов. Кроме того, при циклизации глутамата образуется пролин, входящий в состав коллагена – важного компонента сосудистой стенки. Модификация структуры последней, в сочетании с другими факторами, может сопровождаться развитием эндотелиальной дисфункции [16]. В связи с выявленным нами снижением количества пролина такие последствия вполне вероятны.
Во II триместре беременности околоплодные воды женщин основной группы содержат меньшее количество аланина, по сравнению с аналогичной величиной в контрольной группе. Углеродная цепь аланина постоянно возникает в ходе процессов биологического окисления и снижение интенсивности последнего в условиях осложненной беременности может сопровождаться ограничением синтеза этой аминокислоты. Являясь важным источником энергии для тканей плода, он также служит субстратом таких биоактивных соединений, как карнозин, ансерин, коэнзим А [14].
Важное значение в развитии осложнений беременности имеют отклонения в содержании диаминокислот аргинина и гистидина [17]. Основной причиной повышения уровня аргинина в околоплодных водах во II триместре у женщин основной группы может быть снижение его использования плацентой в качестве источника мощного вазодилататора оксида азота и, как следствие, нарушение фетоплацентарной гемодинамики. Данные последних лет свидетельствуют о регуляторной роли аргинина в экспрессии генов, ответственных за синтез белков (в том числе ферментов), влияющих на баланс про- и антиоксидантных процессов [18], что имеет особенно большое значение в развитии ПЭ. Очевидно, изменение его содержания может вызывать дисбаланс этих процессов. Что касается гистидина, то поскольку он обладает антиоксидантными свойствами [19], снижение его продукции также имеет негативные последствия для течения беременности и развития плода. Помимо этого, на фоне уменьшения гистидина возможно повышение образования его производного – гистамина, обладающего сосудосуживающими свойствами и ухудшающего фетоплацентарный кровоток.
На развитие ПЭ, по-видимому, влияет также уменьшение концентрации триптофана и фенилаланина, обладающих значительной антиоксидантной активностью [12]. Особенно это относится к триптофану [20], содержание которого рассматривается в литературе, как индикатор окислительного стресса. Влияние снижения уровня цистеина в околоплодных водах во II триместре беременности на развитие ПЭ осуществляется, прежде всего, через нарушение синтеза глутатиона, восстановленная форма которого является активным антиоксидантом. Второй путь – снижение участия цистеина в синтезе таурина – аминокислоты, участвующей в антиоксидантных процессах и обладающей мембранопротекторными свойствами [21]. О функционально-метаболическом значении таурина в процессе гестации свидетельствует тот факт, что его концентрация в плаценте превышает концентрацию эссенциальных аминокислот в 2–3 раза [22].
Снижение содержания незаменимых аминокислот с разветвленными боковыми цепями: валина, лейцина и изолейцина во II триместре беременности у женщин основной группы также вносит определенный вклад в развитии ПЭ, поскольку они выполняют важные функции в азотистом и энергетическом метаболизме. Эти аминокислоты используются для синтеза промежуточных соединений ЦТК и глюконеогенеза, регулируют процессы клеточного роста, влияют на секрецию инсулина и трансплацентарный переход других гидрофобных аминокислот [12, 23].
Несомненный интерес для оценки значения нарушения аминокислотного состава околоплодных вод представляет метионин, концентрация которого повышается при ПЭ. Он является ключевым источником метильных групп, необходимых для синтеза пуринов и метилирования ДНК, белков, биогенных аминов, фосфолипидов. Важным продуктом в цепи метаболических превращений метионина является гомоцистеин. Можно предположить, что повышение уровня метионина сопровождается увеличением количества гомоцистеина, который в настоящее время рассматривается как цитотоксический фактор, играющий важную роль на ранних стадиях эндотелиальной дисфункции, а гипергомоцистеинемия приводит к нарушению маточно-плацентарного и фетоплацентарного кровотоков [24, 25]. Важно подчеркнуть, что кроме приведенных нарушений в аминокислотном составе, снижение отношения незаменимых и заменимых аминокислот может приводить к нарушению белкового синтеза.
В отличие от II триместра осложненной беременности, в III триместре на фоне отсутствия или менее значимых изменений для большинства аминокислот околоплодных вод обнаруживается снижение концентрации серина, глицина и треонина. Все три аминокислоты выполняют важные функции, особенно во время беременности [14]. Серин, как и метионин, – участник так называемого одноуглеродного метаболизма, источник метильных групп для синтеза пуриновых нуклеотидов и других соединений. Он является предшественником фосфатидилхолина, сфингомиелина, глицина [26]. Нарушение активности ферментов синтеза и обмена серина связаны с различными патологическими состояниями [27]. В образовании глицина наряду с серином принимает участие треонин, от уровня которого зависит количество глицина [28]. В свою очередь, глицин также активно участвует в метаболической регуляции, синтезе глутатиона, гема, пуринов и порфиринов [29]. Все три аминокислоты через пируват могут метаболизироваться в ацетилкоэнзим А, таким образом связывая их с ЦТК. Между изменением содержания этих аминокислот обнаруживается прямая корреляционная зависимость. Коэффициент корреляции между уровнем серина и глицина равен +0,85 (p=0,023, 95%CI 0,81–0,88), а между содержанием серина и треонина r=+0,84 (p=0,039, 95%CI 0,80–0,88). Снижение их содержания при ПЭ, очевидно, влияет на разные стороны обмена веществ, включая энергетический, липидный, нуклеотидный. Возможно, нарушение именно этих процессов в большей степени является следствием аминокислотного дисбаланса в III триместре при ПЭ, чем изменение про- и антиоксидантных реакций, характерное для II триместра.
В целом, оценивая модификацию аминокислотного спектра в околоплодных водах при ПЭ, следует еще раз отметить, что во II триместре, по сравнению с III триместром имеют место наиболее значимые нарушения. Этот период беременности характеризуется высокой степенью клеточной дифференцировки, интенсивными пролиферативными, анаболическими процессами, реакциями ангиогенеза и апоптоза, происходящими, прежде всего, в плаценте и организме плода. По нашим данным, в контрольной группе женщин во II триместре отмечается более высокий уровень свободных аминокислот, чем в III триместре, что подтверждает его функционально-метаболическую значимость в развитии беременности. Именно нарушения, возникающие в этот период в организме матери, плода и плаценте, зачастую являются причиной осложненного течения беременности в последующем [30]. Подытоживая последствия изменения аминокислотного состава околоплодных вод при ПЭ можно полагать, что большое значение среди них имеют нарушения реакций энергетического обмена, соотношения про- и антиоксидантного баланса, скорости трансплацентарных процессов, реакций метилирования важнейших биосубстратов, синтеза нуклеотидов, белков, фосфолипидов. Изменение всех этих процессов вносит существенный вклад в формирование дисфункции фетоплацентарной системы и создание метаболических, структурных и функциональных предпосылок для развития ПЭ.
Полученные данные свидетельствуют о высокой реактивности метаболизма околоплодных вод в ответ на развитие осложненной беременности и, возможно, их активном участии в формировании повреждений в фетоплацентарном комплексе.
Заключение
Резюмируя полученные данные, можно заключить, что развитие ПЭ происходит на фоне значительных изменений содержания аминокислот в околоплодных водах. Аминокислотный дисбаланс, очевидно, является важной причиной и, в то же время, отражением нарушения гомеостаза в системе мать-плацента-плод. Разные триместры беременности отличаются различной степенью выявленных отклонений в спектре аминокислот. Наиболее выраженные изменения большего количества аминокислот имеют место во II триместре, по сравнению с III триместром. Направленность изменений содержания некоторых аминокислот при ПЭ в III триместре отличается от таковой во II триместре, что указывает на возможность нарушения разных метаболических путей в эти периоды беременности. Результаты настоящего исследования позволяют расширить наши представления о биохимических механизмах формирования и дальнейшего развития ПЭ.



