В клинической практике ключевое значение имеет дифференциальная диагностика доброкачественных и злокачественных опухолей органов малого таза, в частности яичников [1, 2]. Потребности в ранней диагностике и своевременном лечении заболеваний яичников идут вразрез с истинной клинической ситуацией, при которой заболевание выявляется в исходе неоднократных обращений, причем в 65% случаев диагноз устанавливается неверно [3, 4]. Подход к ведению женщин с новообразованиями яичников в первую очередь требует исключения онкологического процесса. Золотым стандартом диагностики считается лапароскопическое вмешательство с последующей гистологической верификацией диагноза (чувствительность: ≥94%, специфичность: ≥79%). По данным рандомизированного исследования 570 женщин, у которых был заподозрен рак яичников (РЯ), лишь у 20 из них (3,5%) диагноз был подтвержден [4, 5]. Также доступны методы предоперационной визуализации – ультразвуковое исследование (УЗИ), магнитно-резонансная томография (МРТ), чувствительность и специфичность которых в ряде клинических ситуаций (например, при перитонеальных гетеротопиях эндометриоза, рецидиве заболевания) не отвечает запросу специалистов [6, 7]. Таким образом, необходимо усовершенствование диагностических методов, которое позволит избежать необоснованных оперативных вмешательств. Кроме того, хирургическое вмешательство ассоциировано с рисками развития осложнений и не может быть использовано в качестве скрининга [8, 9].
Обнаружение опухоль-ассоциированных антигенов является перспективным методом иммунодиагностики, направленным на раннее выявление опухолевого процесса, в том числе овариального эндометриоза.
Целью данного обзора литературы является анализ достижений в области неинвазивной диагностики, а именно сопоставление возможностей и ограничений исследования маркеров биологических жидкостей при образованиях яичников, в частности при эндометриозе.
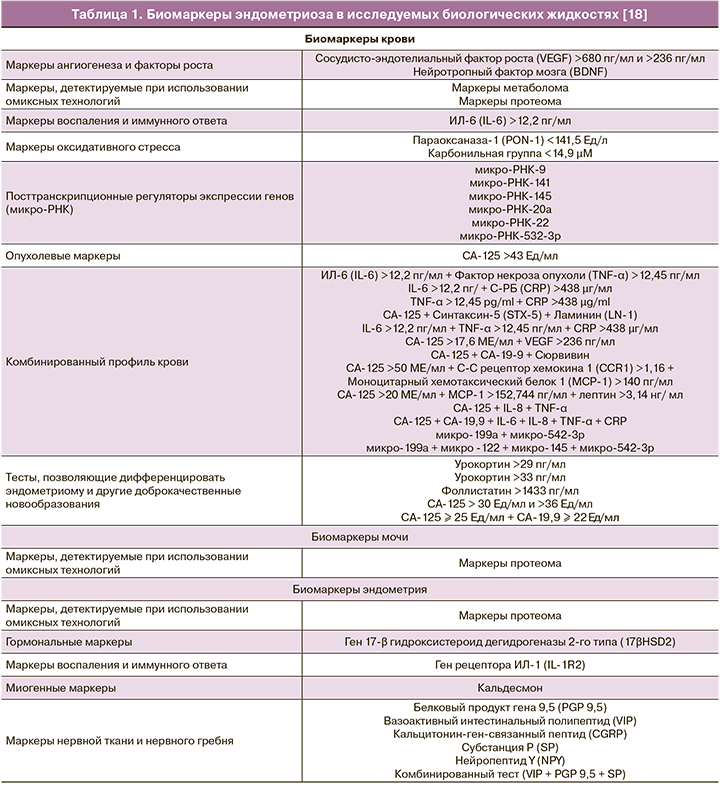
Признаки заболеваний яичников могут быть идентифицированы в виде клеточных или молекулярных маркеров [10–12]. Маркеры обнаружены в сыворотке крови, менструальной жидкости, моче [8, 11, 13–15], перитонеальной жидкости [16], слюне [17], содержимом кист, а также в других биологических жидкостях [5]. Основным требованием, предъявляемым к опухолевым маркерам, является информативность, то есть практическая значимость для выбора лечебной тактики при высоких показателях чувствительности и специфичности тестов по обнаружению интересующего агента. Суммарно в литературе описано более 120 маркеров эндометриоза (табл. 1), однако эти данные по-прежнему не были преобразованы в эффективный диагностический тест [18, 19].
Наиболее изученные биологические маркеры
Периферическая кровь является самым распространенным исследуемым биологическим субстратом, широко внедренным в клиническую практику. Согласно данным метаанализа, четыре маркера на сегодняшний день могут претендовать на статус диагностически важных. К указанной группе относятся антиэндометриальные маркеры, интерлейкин-6 (ИЛ-6), СА-125 и СА-19-9 [20].
A. Vodolazkaia и соавт. [12] провели исследование 353 образцов плазмы крови, продемонстрировавшее высокую информативность (более 80%) некоторых маркеров из разработанных авторами панелей. По сравнению с группой контроля, у пациенток с эндометриозом наблюдалось достоверное повышение уровней протеина-3, связывающего инсулиноподобный фактор роста (IGFBP-3), интерлейкина (ИЛ)-21, CA-125 и гликоделина в фолликулярную фазу. При этом, элевация маркера СА-125 в фолликулярной фазе более 11,5 Ед/мл наблюдалась при УЗИ-негативном эндометриозе. Комбинация 4 биомаркеров (сосудисто-эндотелиальный фактор роста (VEGF), аннексин V, CA-125 и растворимая межклеточная молекула адгезии (sICAM-1)) выявила УЗИ-негативный эндометриоз, который был подтвержден после проведения лапароскопической операции. Таким образом, авторы резюмировали важность разработанных ими панелей для неинвазивного выявления эндометриоза, особенно актуальных в случае отсутствия данных о заболевании при УЗИ (чувствительность до 90%, специфичность до 81%).
Большинство одобренных FDA-маркеров, выявляемых в сыворотке крови при раке яичников, являются гликопротеинами: раково-эмбриональный антиген (РЭА), СА-125, СА 19-9 [21].
Показатель СА-125 является самым распространенным лабораторным маркером новообразований яичников, происходящим из клеток целомического и мюллерова (фаллопиевы трубы, эндоцервикс, эндометрий) эпителия. Данный антиген присутствует на поверхности более 80% немуцинозных эпителиальных злокачественных новообразований яичников и в меньшем проценте случаев обнаруживается при раке эндометрия, маточных труб, канала шейки матки, поджелудочной железы, толстой кишки, молочной железы и легких. СА-125 не обнаруживается на срезах здорового яичника. Референсный интервал составляет ≤35 Ме/мл.
Однако, по данным экспертов, данный интервал подвержен изменчивости в зависимости от ряда процессов (овуляция, фиброз, менструация), что подтверждает изменчивость данного маркера. В связи с обозначенной низкой чувствительностью у женщин репродуктивного возраста обсуждалась необходимость пересмотра значений СА-125 >200 Ед/мл, которые необходимо рассматривать как прогностически ценный для женщин <50 лет [9]. В 1983 г. маркер был одобрен FDA для контоля эффективности терапии РЯ. По данным метаанализа 6 исследований, информативность маркера выше в постменопаузе: чувствительность 69–87% по сравнению с 50–74%, специфичность 81–93% по сравнению с 69–78% [5].
Среди наиболее масштабных исследований, направленных на разработку и внедрение скрининговой программы диагностики РЯ следует назвать UKCTOCS (UK Collaborative Trial of Ovarian Cancer Screening), на протяжении 14 лет включавшее 202 638 женщин, которым проводили мультимодальное обследование посредством применения сонографического исследования наряду с анализом маркера СА-125 с целью потенциально снизить смертность от РЯ [22–24]. Описанные тесты обладают недостаточной предикативной ценностью для включения их в скрининговые программы диагностики образований яичников [21]. Концентрация СА-125 повышается при эндометриоизе и аденомиозе, функциональных кистах яичника и гиперстимуляции яичников, при менструации и беременности, при леойомиомах и других доброкачественных новообразованиях, при синдроме Мейгса, РЯ и раке эндометрия [8]. Кроме этого, концентрация СА-125 повышается при экстрагенитальной патологии и злокачественных новообразованиях за пределами малого таза [3, 25]. Согласно данным скринингового исследования 25 000 женщин PLCO (Prostate, Lung, Colorectal, and Ovarian Cancer), ложное повышение маркера характерно для лиц старше 60 лет и пациенток, имеющих табачную зависимость. Напротив, маркер может быть снижен у пациенток, страдающих избыточной массой тела, и женщин, перенесших гистерэктомию [26].
Группе ученых во главе с Zhang Z. [27] удалось идентифицировать в сыворотке крови больных РЯ экспрессию нескольких белков, которые в дальнейшем былиодобрены FDA для включения в мультивариантный тест OVA1, включивший 5 биомаркеров: аполипопротеин А1, транстиретин, трансферрин, β-2-микроглобулин и СА-125 [21]. В настоящий момент тест OVA1 и его обновленная версия OVA2 применяются в клинической практике для более взвешенного отбора пациентов с объемными образованиями органов малого таза для дальнейшего оперативного вмешательства.
Примерно у четверти пациентов в сыворотке крови одновременно с СА-125 повышается сиалогликопротеин СА19-9, который нашел широкое применение при колоректальном раке. В литературе представлены данные о повышении данного маркера при распространенных стадиях эндометриоза и при муцинозном РЯ [25, 26]. По данным исследования Kurdoglu Z., при новообразованиях яичников отмечена равная специфичность, но сниженная чувствительность маркера по сравнению с СА-125 (52–61% и 86–89% соответственно) [28]. По данным другого исследования, СА-125 обладает более высокими предиктивными свойствами по сравнению с СА19-9 (95% доверительный интервал (ДИ) 0,882–0,993; p=0,001, 0,696); чувствительность (87,7% против 65,0%) и специфичность (87,5% против 62,5%) СА-125 были выше [29].
По данным Shetty V. и соавт., в образцах сыворотки крови пациентов наблюдается снижение содержания десяти гликопептидов, N-концевыми группами которых является сиаловая кислота [30]. Kuzmanov U. и соавт. обнаружили наличие в содержимом кист яичников и асцитической жидкости 13 специфических сиалогликопептидов [31].
Фоллистатин – ингибитор активина (белок эндометриальной ткани, ответственный за процесс децидуализации, однако его гиперэкспрессия наблюдается при эндометриозе), гликопротеин, концентрация которого особенно значимо повышается у пациенток с эндометриозом яичников (чувствительность достигает 69,4–92%, специфичность – 92–100%; масс-спектрометрия). Чувствительность данного маркера при диагностике эндометриом выше, чем аналогичный показатель СА-125, почти в 2 раза (90 по сравнению с 44%) [25, 26]. Однако, по данным других авторов, чувствительность и специфичность определения фоллистатина уступают точности и информативности при обнаружении отклонения СА-125 от референсных значений [31].
Урокортин – нейропептид, принадлежащий к семейству кортикотропин-рилизинг-гормонов. Была выявлена достоверная корреляция повышения данного маркера при эндометриомах (чувствительность 88%, специфичность 90%) по сравнению с прочими новообразованиями яичников, а также превосходство над диагностической ценностью показателя СА-125 при эндометриомах (88% по сравнению с 65%) (табл. 2) [26].

Гликоделин А является промотором неоваскуляризации и пролиферативной активности [2]. Концентрация маркера повышается в сыворотке (чувствительность 82,1%, специфичность 78,4%) и перитонеальной жидкости. По данным одного из исследований, комбинированный тест (гликоделин, ИЛ-6, фактор некроза опухоли-α (ФНО-α)) эффективно способствовал разграничению пациентов с эндометриозом от группы контроля [26]. В описанном выше исследовании Vodolazkaia A. и соавт. гликопротеин продемонстрировал свою эффективность в качестве маркера эндометриоза в ситуациях, когда данные УЗИ не подтвердили диагноз [12].
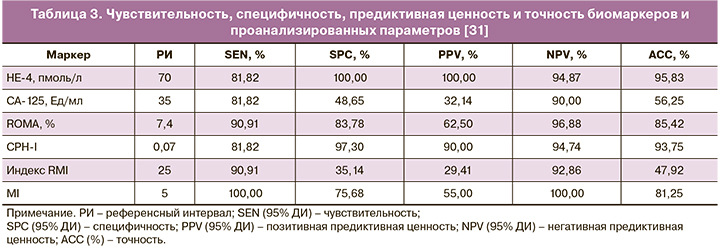
В отличие от СА-125 и прочих изложенных маркеров, для HE-4 (human epididymis protein 4) характерно повышение при злокачественных опухолях яичников (высокий риск злокачественности при ≥70 пмоль/л) [32]. Комплексное исследование СА-125 и HE-4 послужило основанием для создания индекса ROMA (the Risk of Ovarian Malignancy Algorithm). Однако считается, что индекс более точен при расчете для женщин постменопаузального возраста [32–35]. Индекс применим в предоперационном периоде. Результаты трактуются как высокий риск злокачественности при значении ≥13,1% (пременопауза) или ≥27,7% (постменопауза) [8]. В одном из исследований диагностическая эффективность CА-125, HE-4 и индекса ROMA была сопоставлена у 832 пациенток (762 – доброкачественные образования яичников, 70 – РЯ). В то время как повышение СА-125 наблюдалось при миоме матки, аденомиозе, патологии эндометрия и РЯ, статистически значимое повышение HE-4 было отмечено при раке и аденомиозе [36].
Индекс RMI был разработан в 1990 г. и включен в национальные руководства Национального Института Здоровья Великобритании (NICE) [3]. Расчет индекса RMI подразумевает мультимодальный подход, а именно, исследование концентрации СА-125 (Ме/мл), УЗИ органов малого таза (U) и менопаузальный статус (M): RMI I = U × M × CA 125, где U расценивается как 1 балл, если обнаружено одно из нижеперечисленного: многокамерная киста, солидные очаги, метастазы, асцит, билатеральное поражение; М=1 балл (пременопауза), М=3 (постменопауза – отсутствие менструаций в течение 12 месяцев или гистерэктомия в анамнезе у пациенток старше 50 лет).
В исследовании Nikolova T. и соавт. были получены данные об оптимальном использовании HE-4 и CPH-I (Copenhagen Index) в качестве параметров, продемонстрировавших свою эффективность с целью дифференциальной диагностики овариального эндометриоза и РЯ, однако максимальная чувствительность была характерна для MI (Morphology Index) [32]. В данном контролируемом исследовании, в которое вошли 164 женщины пременопаузального возраста, HE-4 и CPH-I продемонстрировали диагностическое преимущество перед СА-125, алгоритмом ROMA, индексами RMI (Risk of Malignancy Index) и MI, – данные представлены в табл. 3.
Новые направления
В связи с недостаточной эффективностью имеющихся методов поиски новых маркеров продолжаются, так как практически все данные противоречивы [36].
Микро-РНК представляют собой мельчайшие некодирующие рибонуклеиновые кислоты, длиной 19–22 нуклеотидов [37]. Изучению микро-РНК при эндометриозе яичников посвящен ряд статей [38, 39]. В обсервационном исследовании «случай–контроль» Cho S. и соавт. получили данные, согласно которым микро-РНК let-7b и miR-135a статистически значимо повышены, а let-7d и 7f понижены в крови больных эндометриозом [9]. Причем степень экспрессии микро-РНК коррелировала с повышением СА-125. Ограничением метода является зависимость уровня циркулирующих микро-РНК от фазы цикла (существенно ниже во время пролиферативной фазы). В контролируемом исследовании Laudanski P. и соавт., в процессе анализа 667 микро-РНК была обнаружена сниженная экспрессия микро-РНК, ответственных за воспаление (miR-483-5p (p= 0,012) и miR-629-3p (p=0,02)) в ткани эутопического эндометрия, полученного в процессе аспирационной биопсии в группе пациенток с овариальным эндометриозом по сравнению с пациентками без эндометриоза [40]. Детальная информация о функции и значении микро-РНК представлена в исследовании Kozomara A. [41].
Одним из привлекательных для изучения диагностического потенциала является митохондриальная ДНК (мтДНК). В одном из недавних контролируемых исследований, опубликованных Creed J. и соавт. на основании анализа послеоперационного материала 150 пациенток репродуктивного возраста с эндометриозом и 32 пациенток группы контроля, были получены данные, подтвердившие диагностическую точность и взаимосвязь митохондриальных делеций длиной 1,2 kb и 3,7 kb у пациенток с эндометриозом брюшины, яичника или с инфильтративным эндометриозом. Чувствительность и специфичность метода для указанных делеций достигли показателей 81,8–85,1% и 57,9–72,2% соответственно[42].
Менструальная кровь является сложной биологической жидкостью, компонентами которой являются клетки эндометрия, кровь, вагинальный секрет, стволовые клетки (мононуклеарные, эндометриальные, мезенхимальные), обладающие потенциалом дифференцироваться в различные соматические клетки, включая нейроны, остеобласты, адипоциты [43, 44]. Исследование компонентов менструальной крови представляется перспективным в связи с наличием в данной биологической жидкости перечня биомаркеров, а также с минимальной инвазивностью метода [6, 7, 45].
Одно из первых исследований протеома данной жидкости было выполнено в 2012 г. Yang H. и соавт. [7]. Структурные изменения эндометрия как гормонозависимой ткани во многом зависят от функционального состояния яичников. Именно ткань эндометрия наиболее чувствительно реагирует на изменения гомеостаза органов репродуктивной системы, в том числе и на функциональные нарушения при формировании опухолей гонад [46]. Исходя из изложенного, следует указать на описанную Володиным М.А. и соавт. [47] способность ряда ферментов и их изоформ накапливаться в апикальных отделах железистых клеток, а затем выделяться в состав эндометриального секрета при гиперпластических процессах и раке эндометрия.
Группа исследователей, Da Silva C.M. и соавт., изучали ферментативный профиль менструальной крови, а также сравнили уровни экспрессии ФНО-α и сосудистого эндотелиального фактора роста (СЭФР) в исследуемом материале женщин репродуктивного возраста [6]. В ходе исследования авторы не получили статистически достоверных данных.
Рядом авторов было доказано, что рост и персистенция эндометриоидных очагов поддерживается перечнем медиаторов (ИЛ-6, ИЛ-8, ФНО-α), активность которых находится под контролем негистоновых компонентов хроматина, – высокоактивного набора 1 (ВАН-1). ВАН-1 также образует комплексы с провоспалительными факторами (с ИЛ-1β и липополисахаридами), которые активируют RAGE (receptor for advanced glycation end products) и TLRs (Toll-like receptors), стимулируя пролиферацию эндотелиальных клеток и высвобождение проангиогенных цитокинов. Shimizu и соавт. [48] провели исследование по обнаружению ВАН-1 в менструальной крови 139 пациенток (84 – эндометриоз, 55 – группа контроля). По полученным данным, концентрация ВАН-1 была существенно выше в менструальной крови по сравнению с двумя другими исследуемыми жидкостями (р<0,001). Авторы предположили, что их данные являются очередным подтверждением гипотезы, что биологически активные компоненты (липополисахариды, активаторы воспаления и ангиогенеза) менструальной крови, в том числе ВАН-1, инициируют эндометриоз вследствие ретроградного заброса и имплантации на ткани–мишени.
Важным фактором, определяющим эффективность исследования интересующего субстрата, является используемый метод диагностики. В отличие от рутинно применяемых микроскопических, иммунологических и молекулярных методов, масс-спектрометрический анализ на ионном уровне идентифицирует исследуемый субстрат, что позволяет использовать метод для изучения диагностической точности маркеров и в последующем акцентировать внимание на оптимальных из них. Метод десорбционной электроспрей-визуализации (DESI-MS) позволяет одномоментно выявить из образцов сотни липидов и метаболитов.
На сегодняшний день омиксные технологии, в том числе метод масс-спектрометрической визуализации, успешно применяются для характеристики молекулярно-биологического профиля исследуемой ткани на субклеточном уровне: позволяют выявить протеины, специфические для доброкачественного или злокачественного новообразования, а также выбрать потенциальные маркеры опухолевого процесса [49, 50]. Ранние исследования периферической крови с помощью тандемной времяпролетной масс-спектрометрии с лазерной десорбцией/ионизацией показали дифференциально экспрессируемые белки и пептиды у женщин с эндометриозом и без него [51].
Как было упомянуто выше, биомаркеры с высокой чувствительностью и специфичностью для диагностики всех стадий эндометриоза были также обнаружены в моче [11, 13–16]. Таким образом, применение тандемной масс-спектрометрии, которая позволяет идентифицировать белки, имеет важное значение для создания неинвазивных тестов на эндометриоз.
Метаболом и отдельные метаболиты в физиологических жидкостях тесно связаны с фенотипическими изменениями, связанными с эндометриозом. На сегодняшний день целевой метаболомный подход сфокусирован на анализе ряда ацилкарнитинов, фосфатидилхолинов и сфинголипидов с целью предоставления дополнительных знаний об участии этих липидных метаболитов в патофизиологии эндометриоза и оценке диагностического потенциала моделей, которые включают комбинации этих липидных метаболитов. Липиды являются компонентами клеточных мембран, выполняющими сигнальную, энергетическую и другие биологические функции, что позволяет использовать их в качестве показателей метаболической активности, которая, как известно, значительно повышается при пролиферативных процессах и при ряде неинфекционных соматических заболеваний [51]. При различных видах онкологических заболеваний наблюдается дисрегуляция липидов. Изменения концентрации липидов были зарегистрированы в сыворотке крови, плазме, моче, а также в опухолевой ткани и культурах клеток [52]. При раке яичников повышается концентрация лизофосфолипидов и сфинголипид-1-фосфата [53]. Получены данные, согласно которым повышение концентрации липидов наблюдается в 39% случаев, снижение – в 4%, изменения концентрации не наблюдается – в 57% [54]. Снижение концентрации ряда липидов может быть связано с повышением интенсивности окисления жирных кислот, а повышение – с синтезом de novo жирных кислот для мембран быстропролиферирующих клеток [55].
Существуют данные о вкладе нарушения метаболизма липидов в процесс метастазирования [56].
У пациентов с эндометриозом наблюдался измененный метаболизм сфинголипидов в сыворотке, перитонеальной жидкости и тканях эндометрия [57]. Ранние метаболомные исследования плазмы крови позволили выявить несколько липидных метаболитов, ацил-алкил-фосфатидилхолинов и сфингомиелинов, которые были значительно повышены у пациентов с эндометриозом по сравнению с контрольной группой [58]. Созданная липидная модель обладает высокой чувствительностью – 90,0% и высокой специфичностью – 84,3%. Эти и другие данные свидетельствуют о том, что фосфатидилхолины и сфингомиелины участвуют в патофизиологии эндометриоза; комбинации этих метаболитов могут быть использованы в качестве биомаркеров для разработки метода неинвазивной диагностики эндометриоза [49, 59, 60]. Dutta M. и соавт. сообщали об увеличении общих концентраций фосфатидилхолинов в образцах сыворотки от пациентов с эндометриозом [61]. Кроме того, участие сфинголипидов в патофизиологии эндометриоза недавно было подтверждено Lee Y.H. и соавт. [62]. Метаболомный подход может быть успешно применен для поиска биомаркеров для диагностики и прогноза заболевания, а также для прогнозирования риска возникновения рецидивов [62, 63]. Перитонеальная жидкость отражает измененную микросреду пациентов с эндометриозом, таким образом, она представляет собой важный источник потенциальных биомаркеров. Липидом перитонеальной жидкости изучался при эндометриозе [59, 61], и были оценены уровни фосфатидилхолинов и ацилкарнитинов в этой физиологической жидкости. Был проведен сравнительный анализ перитонеальной жидкости и плазмы крови как оптимальной физиологической жидкости для диагностики [64].
Заключение
Таким образом, достижения в области изучения биомаркеров образований яичников способствовали накоплению информативных данных, стандартизации методов и отбору наиболее эффективных из них для внедрения в клиническую практику.
Разработка унифицированных диагностических подходов с использованием омиксных технологий позволила бы усовершенствовать возможности своевременной дифференциальной диагностики и конкретизировать показания к выполнению инвазивных вмешательств и оптимизации ведения пациенток с новообразованиями яичников.



