
Особенностью гемодинамики при АЛА является отсутствие прямого сообщения между правым желудочком и системой легочной артерии. Поэтому для сохранения газообмена в легких с последующей оксигенацией органов и тканей необходим обходной путь. В данном случае кровь из правого желудочка через дефект межжелудочковой перегородки поступает в левый желудочек, а далее через аорту и открытый артериальный проток (ОАП) в легкие. ОАП – это фетальная коммуникация, которая после рождения самостоятельно облитерируется в первые дни жизни. Поэтому основным тактическим действием является предотвращение закрытия протока посредством непрерывной инфузии простагландинов вплоть до кардиохирургической коррекции. Также характерной особенностью данного порока является то, что в левом желудочке происходит смешивание венозной и артериальной крови, и, соответственно, в аорту поступает кровь с низкой степенью оксигенации. Следствием является внешний цианотичный вид ребенка, поэтому порок АЛА получил название «синий тип». Тканевая гипоксия органов и тканей, в частности кишечника, является основным этиопатогенетическим звеном в развитии осложнения АЛА как некротизирующий энтероколит. Это инвалидизирующее заболевание периода новорожденности, характеризующееся воспалением кишечной стенки и ее некрозом. Значимыми факторами в развитии НЭК является недоношенность и масса тела при рождении менее 1500 г, что обусловливает частоту данной патологии у каждого двадцатого новорожденного, а в комбинации с АЛА НЭК может развиться у каждого второго ребенка. Соответствующая осведомленность определяет следующее тактическое действие на дооперационном этапе, а именно проведение ежедневного мониторинга УЗИ брюшной полости, что позволяет диагностировать НЭК на доклиническом этапе его реализации за счет визуализации газа в портальной системе печени, который является значимым диагностическим критерием НЭК. Данная тактика позволяет своевременно начать антибактериальную терапию, предотвратить тяжелое течение НЭК и связанную с ним высокую летальность (рис. 1).
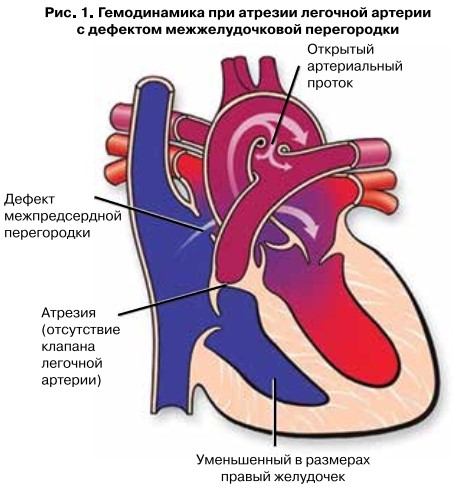
Атрезия легочной артерии нашему пациенту второму из монохориальной диамниотической двойни диагностирована на 27 нед внутриутробного развития. На 33 нед рожден путем операции кесарева сечения, проведенной в связи с преждевременным излитием околоплодных вод и селективной задержкой внутриутробного развития. Оценка по шкале Апгар 5/7 баллов. Масса тела при рождении 1220 г, длина 39 см, окружность головы 28 см, что ниже показателей, соответствующих гестационному возрасту. В первый час жизни проведено УЗИ сердца, подтверждена АЛА, налажена непрерывная инфузия простагландинов через центральную венозную линию, назначено полное парентеральное питание, энтеральное питание не проводилось и в 12 ч жизни ребенок переведен в НЦССХ им. А.Н. Бакулева для проведения кардиохирургической коррекции. После проведения КТ и детального изучения архитектуры сердечно-сосудистой системы было выявлено, что диаметр сосудов не превышает 1–1,5 мм, и соответственно оперативное вмешательство будет возможно не ранее достижении массы тела 2 кг. В возрасте 9 сут жизни ребенок был переведен на дооперационное выхаживание вновь в ФГБУ НМИЦ АГП им. акад. В.И Кулакова в отделение патологии новорожденных и недоношенных детей № 2. Принимая во внимание высокую вероятность развития некротизирующего энтероколита и высокую летальность, связанную с его развитием, вопрос энтеральной нутритивной поддержки вызывал максимальную обеспокоенность. Предпосылкой данной ситуации явилось устойчивое мнение, что энтеральный субстрат может являться провоцирующим механизмом в развитии некротизирующего энтероколита у скомпрометированного новорожденного с пороком синего типа, а также отсутствие в РФ соответствующего экспертного опыта. Полагаясь на международные практики нутритивной поддержки, доказывающие безопасность как трофического, так и полного энтерального питания у новорожденных с пороками «синего» типа, если в качестве источника будет использовано грудное молоко, нами была выбрана соответствующая тактика под контролем клинической переносимости питания и ежедневного УЗИ брюшной полости. На 12 день жизни по данным УЗИ верифицирован газ в портальной системе печени. Диагностирован НЭК степени 2А. Важно отметить, что клинических и рентгенологических признаков интолерантности энтерального питания и НЭК не отмечалось. Длительность энтеральной паузы составила 13 дней. На 25 сут жизни возобновлено вскармливание нативным молоком, и целевой объем 140 мл/кг/сут достигнут в течение 10 дней.
Также особенностью детей с врожденными пороками сердца «синего» типа является постнатальная недостаточность питания, характеризующаяся выраженным дефицитом массы тела как на до-, так и на послеоперационном этапе. Учитывая данное, несмотря на полный объем энтерального питания и невозможность обогащения грудного молока дополнительными белково-энергетическими компонентами ввиду повышения осмолярности конечного продукта, на протяжении всего дооперационного периода ребенок также получал оптимальное парентеральное питание с суммарной дотацией белка 4 г/кг/сут, углеводов 14 г/кг/сут, жира 6 г/кг/сут, что соответствовало потребностям фактического нутритивного статуса пациента. Коррекция парентерального и энтерального питания проводилась еженедельно в зависимости от показателей физического развития, полученных на основании перцентильных шкал INTERGROWTH-21. Такая персонифицированная предоперационная нутритивная тактика позволила обеспечить прибавку массы тела 17 г/кг/день и достичь 2 кг в течение 32 дней, что соответствует скорости роста плода и обусловливает нахождение «весовой кривой» в пределах перцентильного коридора, установленного при рождении (рис. 2).
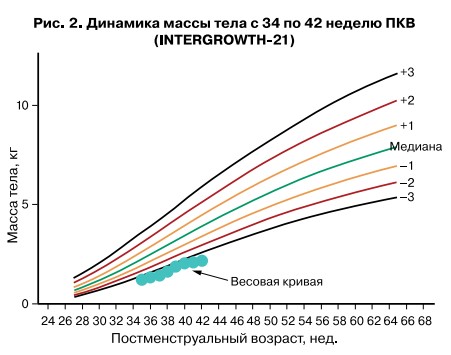
Персонифицированная нутритивная стратегия – это регулируемый фактор, который позволил предотвратить развитие тяжелого течения НЭК и тяжелой постнатальной гипотрофии – ключевых моментов, определяющих финал дооперационного этапа. Полученный эффект подчеркивает важность управления питанием у недоношенных детей с критическими пороками сердца «синего типа».



