Привычное невынашивание беременности (ПНБ) является наиболее распространенной проблемой фертильности женщин и определяется как две или более последовательных потери беременности [1–3]. ПНБ встречается у 0,5–3% супружеских пар и может быть вызвано различными причинами, такими как хромосомные или анатомические нарушения, инфекции, иммунологические причины, а также неизвестные причины [1–4], которые обусловливают идиопатическую форму ПНБ (иПНБ).
Большинством исследователей ПНБ рассматривается как полигенное расстройство, связанное как с генетическими, так и с факторами окружающей среды, но не исключается и моногенная этиология ПНБ. В качестве кандидатного гена изучался ген SYCP3, кодирующий одноименный белок (ОMIM 270960) синаптонемного комплекса, отвечающий за правильную сегрегацию и рекомбинацию гомологичных хромосом во время мейоза I или II, нарушения которых реализуются азооспермией, высокой частотой анеуплоидий и снижением пула ооцитов [5–7].
Показано, что носительство точечной мутации (657T>C) в гене SYCP3 приводит к частым хромосомным аномалиям эмбриона и служит причиной ПНБ [5, 6].
Из-за сложности мейоза, большого числа разнообразных генов, вовлеченных в этот процесс, низкой популяционной частоты (657T>C) полиморфизма гена SYCP3 ряд исследователей высказали сомнения, что мутация в одном гене может явиться причиной ПНБ у большого числа пациентов [8].
Mizutani E. и соавт. [9] отметили, что для расширения информации о молекулярных механизмах, связанных с рецидивом потери беременности, включение анализа мутации (657T>C) SYCP3 в клинический протокол обследования при ПНБ требует дальнейших исследований на значительных популяционных выборках.
Поскольку результаты популяционных исследований неблагоприятных полиморфизмов варьируют в зависимости от различных расовых и географических условий, нами исследована этнически однородная популяция казахов. Для исключения возможного аддитивного вклада многих факторов в этиологию ПНБ нами отобрана группа с иПНБ, в которой причины рецидивирующих ранних потерь беременности были неизвестны.
Целью настоящего исследования явилась оценка популяционной частоты и возможного генетического вклада полиморфизма 657T>C гена синаптонемного комплекса SYCP3 (rs769825641) в развитие иПНБ в этнически однородной популяции казахов.
Материалы и методы
Исследование проводили проспективным методом в поликлиническом отделении Научного центра акушерства, гинекологии и перинатологии (НЦАГиП), медицинском центре «Центр молекулярной медицины». Все участники исследования дали информированное согласие на использование своих образцов крови и анамнестических данных, получено разрешение этического комитета НЦАГиП на проведение данных исследований.
Основную группу с иПНБ составили 302 женщины казахской национальности; возраст 18–45 лет; два и более выкидышей до 12 недель беременности. Контрольная группа представлена 300 женщинами-казашками с нормальной репродуктивной функцией, имеющих хотя бы одного ребенка, без указаний на наличие самопроизвольных выкидышей.
Критерии включения для основной группы с иПНБ: принадлежность к казахской национальности по дедушкам и бабушкам по материнской и отцовской линии; возраст 18–45 лет; наличие 2 и более ранних самопроизвольных выкидышей; наличие беременностей было подтверждено данными ультразвукового исследования (УЗИ) и/или гормонами беременности.
Критерии исключения: нарушения лютеиновой фазы в результатах биопсии эндометрия, анатомические аномалии матки по данным УЗИ, гистеросальпингографии, гистероскопии или соногистероскопии, носительство сбалансированных хромосомных аномалий методом кариотипирования обоих супругов, наличие антифосфолипидного синдрома (АФС), подтвержденного анализом определения антител к кардиолипину (IgG/IgM), волчаночного антикоагулянта; инфекций, передающихся половым путем, подтвержденных двумя различными анализами биологических материалов (иммуноферментный анализ, метод полимеразной цепной реакции), нарушения функции щитовидной железы по анализам тиреотропного гормона (ТТГ) и тиреоидных антител.
Материалом исследования группы популяционного контроля послужила ДНК, которая представлена 700 условно здоровыми лицами казахской национальности. ДНК исследуемых хранятся в биобанке «Мирас» НЦАГиП, который был создан в рамках проекта «Генетические исследования преэклампсии в популяциях Центральной Азии и Европы» по 7-рамочной программе Европейской Комиссии по грантовому соглашению № 282540.
Биобанк ДНК «Мирас» предназначен для хранения образцов ДНК, содержит геномную и клиническую информацию о более чем 10 000 исследуемых индивидуумов казахской национальности. Все обследуемые были поставлены в известность о целях выполняемого проекта и подписали информированное согласие в его участии. Критерии для отбора в группу популяционного контроля: этническая принадлежность – казахи, включая дедушек и бабушек; возраст 18 лет и старше; дееспособность субъекта принимать самостоятельное решение о согласии для участия в проекте. Критерии исключения: наличие в анамнезе подтвержденных медицинскими документами гипертонической болезни, инсульта, сахарного диабета 1, 2 типов, требующих медикаментозного лечения.
Выделение ДНК проводили методом разделения магнитных частиц M-PVA на автоматическом анализаторе Prepitto (PerkinElmer) для выделения нуклеиновых кислот Chemagic Prepito (Wallac, Финляндия) с использованием комплекта реагентов PrepitoDNACytoPure.
Молекулярно-генетические исследования проведены TaqMan-методом единой сайт-специфичной амплификации и генотипирования в реальном времени (Real-Time PCR) с использованием тест-систем («ТестГен», Россия) для молекулярно-генетических исследований.
Анализ непараметрического критерия χ2, оценку влияния носительства полиморфных вариантов гена на риск развития заболевания проводили с помощью отношения шансов (OШ) с учетом 95% доверительного интервала (95% ДИ) с использованием программного обеспечения PLINK [10]. Результаты анализа считали статистически значимыми при уровне р<0,05.
Статистический анализ с использованием программы PLINK включает расчет ассоциативных взаимодействий между исследуемыми группами на основе различных моделей: аллельной (ALLELIC), генотипической (GENO), аддитивной (TREND трендовой), доминантной (DOM) и рецессивной (REC).
Отклонение от равновесия Харди–Вайнберга было проверено с использованием программного обеспечения PLINK на основе расчетов наблюдаемой (Ho) и ожидаемой (He) гетерозиготности [10].
Результаты
Ген SYCP3 (rs769825641, 657T>C) расположен на длинном плече хромосомы 12 (12q23.2); кодирует белок Synaptonemal complex protein 3, физическое расстояние в спаренных основаниях (base-pair position – bp) –101729109 [11].
Изучены особенности распределения частот генотипов и аллелей полиморфизма 657T>C гена SYCP3 в казахской популяции в популяционном контроле. Популяционные частоты аллелей полиморфизма гена SYCP3 были рассчитаны на 700 образцов ДНК. По данным National Center for Biotechnology Information [11], во многих популяциях мира частота неблагоприятного аллеля С не была обнаружена на выборках от 15 000 до 130 000 населения, данные представлены в табл. 1.
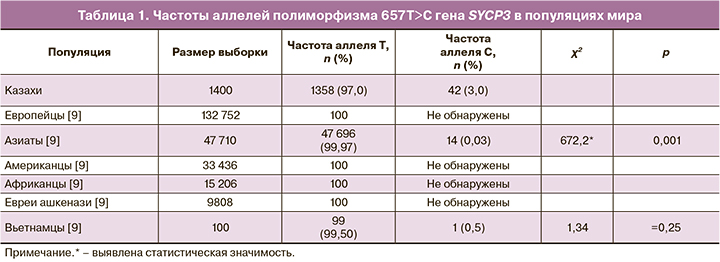
Генотип ТТ в популяционном контроле составил 94,0%, гетерозиготный генотип СТ – 6,0%, аллель Т – 97,0%, неблагоприятный аллель С в гене SYCP3 (657T>C) в казахской популяции составил 3,0%, что оказалось достоверно выше (р<0,001) по сравнению с аналогичным показателем для азиатских популяций (0,03%)[11] (табл. 1).
В программе PLINK рассчитаны частоты генотипов полиморфизма 657T>C гена SYCP3с определением наблюдаемой (0,113) и ожидаемой (0,144) гетерозиготности, и было выявлено несоответствие равновесию Харди–Вайнберга (р<0,001), что, возможно, обусловлено недостаточным объемом выборки для данного полиморфизма и историческими закономерностями формирования генофонда казахской популяции.
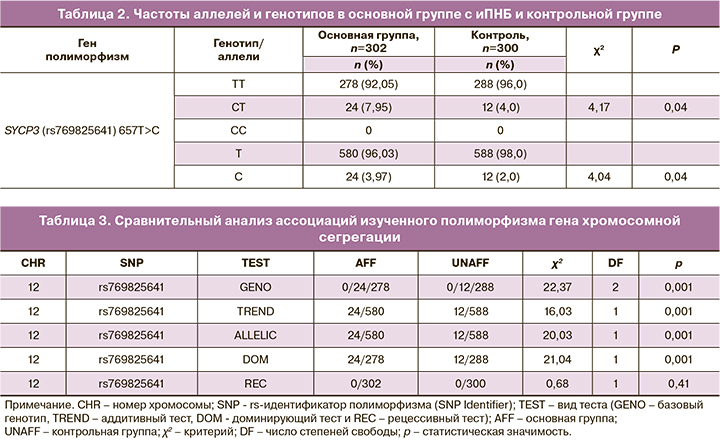
Сравнительный анализ аллельных и генотипических частот SYCP3 (rs769825641) 657T>C полиморфизма в группе с иПНБ и контроля представлен в табл. 2. Как видно из табл. 2, частота носительства неблагоприятного аллеля С в основной группе составила 4,0%, что достоверно превышало аналогичный показатель у женщин с нормальными показателями репродукции – 2,0% (χ2=4,04; р=0,04). Следует отметить, что гомозиготный неблагоприятный генотип С657С в обследуемой выборке не обнаружен, что, вероятно, обусловлено редкой частотой встречаемости аллеля в казахской популяции. В группе с иПНБ благоприятный гомозиготный генотип Т657Т встречался достоверно реже – в 92,0%, а неблагоприятный гетерозиготный С657Т генотип достоверно чаще – в 7,95%, что достоверно превышало их частоты у женщин с нормальной репродукцией – 96,0 и 4,0% соответственно (χ2=4,17; р=0,04), что подтверждается значениями OШ=2,1 (95% ДИ 1,02–4,22).
Полученные нами результаты совпадают с данными Bolor H.и соавт. [5], которые обнаружили у 26 японских женщин с ПНБ один гетерозиготный генотип С657Т гена SYCP3, частота носительства которого в основной группе составила 3,0% и не встретилась у 150 женщин с нормальной репродукцией. Это позволило авторам предположить, что С657 мутация в гене синаптонемного комплекса SYCP3 может рассматриваться как генетический предрасполагающий фактор ПНБ.
Аналогичные данные опубликованы по результатам исследования полиморфизма T657C гена SYCP3 у 100 иранских женщин с иПНБ и 100 контрольных женщин с нормальной репродуктивной функцией, имеющих хотя бы одного здорового ребенка. Частота носительства неблагоприятного гетерозиготного генотипа в основной группе составила 7,95% и достоверно превышала частоту 4,0% в контрольной группе (p<0,005), что свидетельствует, что данный полиморфизм можно рассматривать как генетический фактор иПНБ [7].
Вместе с тем имеются публикации Mizutani Е. и соавт. [9], которые обнаружили по одной мутации SYCP3 657T>C у 101 женщины с ПНБ и среди 82 с нормальной репродукцией. Анализ кариотипов абортусов показал, что пациенты с носительством мутации (СТ) и нормальным генотипом (ТТ) не имели достоверных отличий по частоте хромосомных нарушений в абортном материале, что не позволило доказать генетический вклад данной мутации в развитие анеуплоидий при ПНБ.
Расчеты ассоциаций изученного полиморфизма гена SYCP3 с использованием различных моделей представлены в табл. 3.
Статистический анализ с использованием программы PLINK включает расчет ассоциаций на основе различных моделей. Аллельная модель (ALLELIC) основана на оценке силы ассоциации аллельных частот, является наиболее простым тестом, который не учитывает общий генотип двух хромосом, поэтому нами использованы более точные модели генотипических тестов. Генотипический тест (GENO) ассоциаций SNP полиморфизмов с риском иПНБ основан на использовании частот трех возможных генотипов в основной и контрольной группах. Единицей расчета является не аллель, а три возможных генотипа с df=2. По условиям аддитивной (TREND трендовой) модели, наличие двух копий минорного аллеля в гомозиготном неблагоприятном генотипе более сильнее связано с развитием иПНБ, чем наличие одного аллеля в гетерозиготном генотипе. В основе аддитивной математической модели лежит правило, что чем больше копий минорного аллеля имеется в исследуемой группе, тем больший неблагоприятный эффект на риск развития иПНБ имеют гетерозиготы с фенотипами, лежащими между двумя гомозиготами. Этот тест имеет 1 df и известен как «Тест Cochran–Armitage для тренда».
Доминантная модель (DOM) предполагает, что заболевание проявляется только в том случае, если имеется хотя бы одна копия неблагоприятного аллеля. Все обследуемые классифицированы на две группы в зависимости от того, имеется или нет минорный аллель, доминантный тест имеет 1 df. Рецессивная модель (REC) предполагает, что эффект на фенотип проявляется только в том случае, если у обследуемого есть две копии минорного аллеля, число степеней свободы равно 1. Наиболее значимой, если мы не уверены в генетической модели ассоциации между генотипом и фенотипом, является аддитивная модель, которая в меньшей степени основана на принципе наследования, но статистически менее эффективна из-за дополнительной степени свободы.
В табл. 3 представлены результаты сравнительного анализа ассоциаций изученного полиморфизма с иПНБ, основанного на использовании нескольких моделей при пороге значимости в p≤0,05 для множественного тестирования.
Как видно из табл. 3, для изученного полиморфизма гена хромосомной сегрегации были обнаружены статистически значимые ассоциации иПНБ, которые подразумевают конкретную взаимосвязь между генотипом и фенотипом, включают статистически значимые различия по генотипической, аддитивной (трендовой), доминирующей и аллельной моделям (p<0,001).
Не выявлены достоверные ассоциации при использовании рецессивной модели, что позволяет предположить случайный тренд, связанный с низкой частотой неблагоприятного минорного аллеля в данном полиморфизме, которая составила 4,0%.
Таким образом, полученные нами результаты свидетельствуют о возможной значимости данного полиморфизма (657T>C) гена хромосомной сегрегации SYCP3 в развитии иПНБ. Носительство неблагоприятного аллеля С увеличивает риск развития иПНБ в 2 раза, о чем свидетельствует показатель отношения шансов (OШ=2,03; 95% ДИ 1,0–4,09).
Обсуждение
Генетические аспекты иПНБ остаются до конца не известными, репликативные исследования полиморфизма 657T>C гена хромосомной сегрегации SYCP3 в различных этнических популяциях немногочисленны и противоречивы. Возможными объяснениями могут служить различия в критериях рекрутинга иПНБ, малочисленность обследуемых выборок, этническая принадлежность и чрезвычайно низкая популяционная частота гетерозиготных генотипов [7, 12, 13].
Частота носительства неблагоприятного аллеля С в гене SYCP3 (rs769825641) в казахской популяции оказалось достоверно выше (р<0,0001) его популяционной частоты в изученных азиатских популяциях [11].
Сравнительный анализ аллельных и генотипических частот SYCP3 (rs769825641) 657T>C полиморфизма в группе 302 женщин с иПНБ и 300 – с нормальной репродукцией выявил достоверные различия по более высокой частоте неблагоприятного аллеля С в группе с иПНБ (3,97%) по сравнению с контролем (2,0%). Частоты гетерозиготного генотипа СТ в сравниваемых группах пациентов с иПНБ и контролем составили 7,95 и 4,0% соответственно, что имеет статистическую значимость (р=0,042).
Полученные результаты в этнически однородной казахской популяции свидетельствуют о возможном генетическом вкладе полиморфизма (657T>C) гена хромосомной сегрегации SYCP3 в этиологию иПНБ, что подтверждается значимым показателем отношения шансов (OШ=2,03).
К сожалению, чрезвычайно низкая частота носительства мутации SYCP3 657С в большинстве популяций человека исключает возможность использования ее в качестве скринингового теста при обследовании семей с ПНБ.
Заключение
Наши результаты представляются логичными и указывают на то, что белки синаптонемного комплекса играют важную роль в успешности мейоза при иПНБ, что позволяет рассматривать изученный полиморфизм как возможный генетический фактор иПНБ с неустановленными причинами. Из-за сложности мейоза, большого числа разнообразных генов, вовлеченных в этот процесс, представляется маловероятным, что мутация в одном гене является причиной повторного прерывания беременности у большого числа пациенток, что требует дальнейших масштабных исследований других полиморфизмов генов мейотической рекомбинации.



