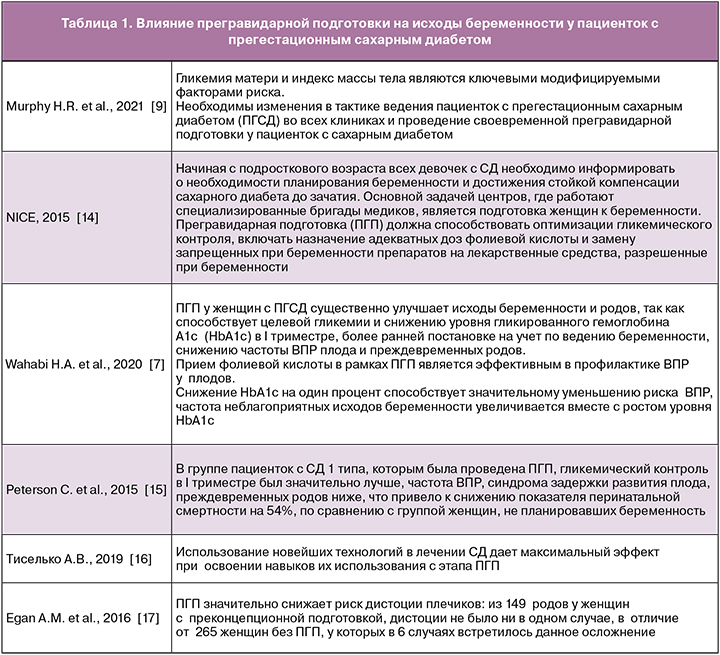
Сахарный диабет (СД) – одно из самых распространенных хронических заболеваний у женщин фертильного возраста. В Российской Федерации на 01.01.2021 г., по данным национального регистра, численность пациентов с СД, находящихся на диспансерном учете, составила 4799 552 человек (3,23% населения РФ), из них 265,4 тыс. человек (5,5%) имеют СД 1 типа [1].
Доказано, что высокий уровень глюкозы в крови и гликированного гемоглобина (HbA1c) во время беременности повышают риски осложнений течения беременности и исхода родов как у матери, так и у ребенка, увеличивая частоту невынашивания беременности, преэклампсии, преждевременных родов, оперативного родоразрешения и диабетической фетопатии, в особенности врожденных пороков развития (ВПР) [2]. За последние два десятилетия отмечается негативная тенденция к увеличению индекса массы тела у пациентов с СД 1 типа. Это связано не только с неправильным питанием и ограничением физической активности вследствие боязни гипогликемических состояний, но и с хронической передозировкой инсулина. Распространенность избыточного веса и ожирения у пациентов с СД 1 типа репродуктивного возраста достигает 50–60% [3, 4]. Ожирение является независимым фактором ВПР плода, особенно пороков сердца. Частота дефектов межпредсердной и межжелудочковой перегородок, открытого артериального протока, транспозиции магистральных сосудов увеличивается параллельно индексу массы тела [5, 6]. Планирование беременности при СД 1 типа существенно улучшает исходы беременности и родов [7–11] и позволяет снизить риск не только ВПР, но и перинатальной смертности и неонатальной заболеваемости, а также является экономически оправданным [12, 13].
Наступление беременности нежелательно при:
- уровне HbA1c>7,0%;
- суточной протеинурии ≥3,0 г;
- уровне креатинина в сыворотке крови >120 мкмоль/л, расчетной скорости клубочковой фильтрации <60 мл/мин/1,73 м²;
- неконтролируемой артериальной гипертензии;
- пролиферативной ретинопатии и макулопатии до проведения лазерной коагуляции сосудов сетчатки;
- ишемической болезни сердца;
- тяжелой гастроэнтеропатии: гастропареза, диареи;
- наличии острых и обострении хронических инфекционно-воспалительных заболеваний [18].
Наиболее высокая эффективность лечения СД во время беременности отмечена в специализированных центрах, где женщины с различными типами диабета находятся под наблюдением врачей нескольких специальностей: эндокринолога, акушера-гинеколога, нефролога, офтальмолога и перинатолога. На базе отдела гинекологии и эндокринологии ФГБНУ «НИИ АГиР им. Д.О. Отта» с 1962 г. основан и функционирует специализированный центр по планированию и ведению беременности у пациенток с СД. Разработан эффективный алгоритм наблюдения пациенток с СД 1 типа. Амбулаторно женщины посещают эндокринолога и акушера-гинеколога на этапе планирования беременности с частотой 1 раз в месяц, до 30-й недели беременности – 1 раз в 2 недели, после 30-й недели еженедельно [19].
Среди факторов, которые способствуют благоприятному течению беременности у пациенток с СД 1 типа, можно выделить следующие:
- достижение нормогликемии с момента дебюта заболевания и на всем его протяжении, что позволяет минимизировать риски и выраженность сосудистых осложнений диабета и способствует сохранению репродуктивного здоровья;
- планирование беременности;
- введение более строгих критериев компенсации СД, приближенных к физиологическим;
- использование высокоочищеннных генно-инженерных инсулинов человека и аналогов инсулина, имеющих более физиологический фармакодинамический профиль;
- внедрение помповой инсулинотерапии, непрерывного мониторирования гликемии, флеш-мониторинга;
- тщательное дородовое наблюдение;
- оптимизация неонатального ухода.
Начиная с периода полового созревания необходимо информировать пациенток о рисках незапланированной беременности и важности проведения прегравидарной подготовки при сахарном диабете. На этапе планирования беременности всем больным СД 1 типа рекомендовано обучение в «Школе для пациентов с сахарным диабетом» с целью достижения целевых уровней гликемического контроля за 3–4 месяца до зачатия:
- глюкоза плазмы натощак, перед едой, на ночь, ночью <6,1 ммоль/л;
- глюкоза плазмы через 2 часа после еды <7,8 ммоль/л;
- HbA1c<6,5% [18]. Уровень HbA1c<6,5% с этапа ПГП связан с самым низким риском врожденных аномалий, преэклампсии и преждевременных родов [20, 21].
Также в перечень мероприятий по планированию беременности при СД входят следующие [18, 19].
- Оценка состояния глазного дна. Комплексное офтальмологическое обследование с биомикроскопией глазного дна с медикаментозно расширенным зрачком для оценки стадии ретинопатии и при необходимости проведение достаточной лазерной коррекции сетчатки с достижением стойкого эффекта, что минимизирует риск прогрессирования диабетической ретинопатии во время беременности.
- Оценка стадии хронической болезни почек (ХБП), при необходимости консультация нефролога. При наличии ХБП имеется повышенный риск преэклампсии, преждевременных родов, оперативного родоразрешения, синдрома задержки внутриутробного развития плода [22–24]. С нефропротективной целью рекомендован прием ингибиторов АПФ или блокаторов рецепторов ангиотензина II при ХБП не менее 6 месяцев до предполагаемого зачатия.
- Достижение целевого значения артериального давления не более 130/80 мм рт. ст., при артериальной гипертензии заблаговременный перевод с фетотоксичных препаратов – ингибиторов АПФ, блокаторов рецепторов ангиотензина II на разрешенную во время беременности антигипертензивную терапию (метилдопа, блокаторы кальциевых каналов, ß1селективные адреноблокаторы).
- Обучение больных методам саморегуляции диабета. В случаях планируемого применения программ ВРТ заблаговременный перевод на постоянную подкожную инфузию инсулина и обучение навыкам помповой инсулинотерапии с целью уменьшения вариабельности гликемии в протоколах ЭКО и во время беременности, мотивации на ежедневный частый самоконтроль гликемии (не реже 7 раз в сутки), обучения особенностям изменения потребности в инсулине во время протокола ЭКО, во время беременности, в родах и послеродовом периоде.
- Кардиологическое обследование (ЭКГ, эхокардиография, мониторинг артериального давления) у больных с продолжительностью заболевания более 10 лет для исключения ишемической болезни сердца и автономной нейропатии.
- Определение в крови уровней свободного тироксина, тиреотропного гормона (ТТГ) и аутоантител к тиреоидной пероксидазе для выявления аутоиммунного тиреоидита (АИТ), нередко сопутствующего СД 1 типа, и своевременного назначения препаратов левотироксина при обнаружении гипотиреоза. При АИТ резервы щитовидной железы снижены и более вероятно развитие гипотиреоза во время беременности. При наличии манифестного (уровень ТТГ более 10,0 мЕд/л) и субклинического гипотиреоза (уровень ТТГ более 4,0 мЕд/л и повышенный титр антител к тиреопероксидазе) рекомендован прием препаратов левотироксина с этапа ПГП. Целью лечения будет являться уровень ТТГ стабильно ниже 2,5 мЕд/л [25]. При контролируемой гиперстимуляции яичников в протоколах ЭКО отмечается повышение уровня ТТГ и снижение уровня свободного Т4.
- Санация очагов хронической инфекции, часто сопутствующей СД 1 типа.
- Назначение фолиевой кислоты в дозе 400–800 мкг/с за 2 месяца до предполагаемого зачатия с целью снижения риска диабетической эмбриопатии. Более высокие дозы – 5 мг/сут., рекомендованные в США, Великобритании и некоторых других странах [15], в РФ назначаются только по показаниям (гипергомоцистеинемия и др.)
- Генетическое консультирование при наличии ВПР плода в анамнезе, в случае СД 1 типа у супруга. Риск развития СД 1 типа у ребенка в течение жизни: около 2% – при СД 1 типа у матери, около 6% – при СД 1 типа у отца, 30–35% – при СД 1 типа у обоих родителей.
- Отказ от вредных привычек.
- На весь период ПГП необходима надежная и эффективная контрацепция.
По достижении идеальной компенсации СД, после стабилизации диабетических микрососудистых осложнений, обучения в школе «Сахарный диабет и беременность» и коррекции сопутствующих заболеваний возможно наступление беременности.
Учитывая негативное влияние гипергликемии на репродуктивное здоровье женщины, растущее число женщин как с СД, так и с бесплодием, вопрос применения экстракорпорального оплодотворения у женщин с СД 1 типа представляется как никогда актуальным.
На данный момент в развитых странах число детей, рожденных после ЭКО, составляет от 1 до 3% от общего числа родившихся [26]. Однако по-прежнему больные СД 1 типа нечасто попадают в поле зрения врачей-гинекологов, занимающихся лечением бесплодия с применением вспомогательных репродуктивных технологий. Улучшение качества лечения СД 1 типа, введение в практику интенсивной инсулинотерапии, постоянной подкожной инфузии инсулина и адекватного контроля гликемии в последние два десятилетия оказали положительное действие на показатели фертильности у больных СД 1 типа. Однако у части пациенток с СД 1 типа наблюдаются ановуляция, непроходимость маточных труб, мужской фактор бесплодия и другие причины бесплодия, требующие стимуляции овуляции и/или ЭКО. При выполнении ЭКО у женщин с СД 1 типа необходимо руководствоваться приказом Министерства здравоохранения РФ от 31 июля 2020 г. N803н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [27], клиническими рекомендациями «Алгоритмы специализированной медицинской помощи больным сахарным диабетом» Министерства здравоохранения РФ (2021) [18].
У женщин с СД 1 типа, планирующих ЭКО, ПГП особенно важна. Есть данные, что гипергликемия оказывает негативное влияние на созревание и развитие ооцитов, а также эмбриона [28–30]. Как следствие, мы можем ожидать снижения числа успешных попыток ЭКО при некомпенсированном сахарном диабете. У женщин с СД 1 типа, планирующих беременность, риск неблагоприятных исходов беременности и родов снижается как минимум вдвое [31].
В Приказе Министерства здравоохранения № 803н от 31 июля 2020 г. «О порядке использования репродуктивных технологий, противопоказаниях и ограничениях к их применению» указывается, что выполнение ЭКО является возможным при неэффективном лечении бесплодия в течение 12 месяцев при возрасте женщины до 35 лет или в течение 6 месяцев при возрасте 35 лет и более. Это особенно важно для пациенток с СД 1 типа, у которых длительное течение заболевания нередко сопровождается развитием сосудистых осложнений. С учетом того, что длительность периода планирования беременности зависит от степени компенсации СД и в среднем составляет 6–9 месяцев, это требует от врача и пациентки реализации репродуктивных задач как можно раньше.
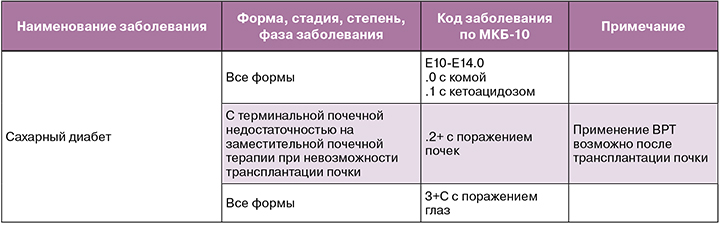
В Приказе № 803н перечислены осложнения СД, при которых применение вспомогательных репродуктивных технологий противопоказано [27].
- Особенностью подготовки у больных СД 1 типа, планирующих применение ВРТ, является достижение целевых показателей гликемии и HbA1c.
- Обязательным условием является комплексная ПГП. На этом этапе целесообразны перевод на постоянную подкожную инфузию инсулина (ППИИ), обучение навыкам помповой инсулинотерапии с целью минимизации вариабельности гликемии на фоне проведения овариальной стимуляции и гормональной поддержки посттрансфертного периода [32].
- Пациентки должны находиться под наблюдением эндокринолога, так как в ходе стимуляции суперовуляции за счет дополнительной гормональной нагрузки отмечается выраженная вариабельность гликемии, требующая изменения режима и доз ППИИ.
Влияние протоколов ЭКО на уровень гликемии у больных СД 1 типа мало освещено в литературе. Есть данные, свидетельствующие о тенденции к гипергликемии в протоколах ЭКО у женщин, не имеющих нарушений углеводного обмена (преддиабет и СД) [33]. Согласно нашим данным, суточная доза инсулина в протоколах ЭКО увеличивается на 15–25% [34]. Отмечается увеличение болюсных доз инсулина в вечерние часы, что является характерным для пациенток с прегестационным СД (СД 1 и 2 типа), получающих препараты прогестерона [34]. Следует отметить, что при ведении протоколов ЭКО, у пациенток с СД 1 типа репродуктологи в протоколах ВРТ все чаще используют сегментированные циклы, что позволяет исключить неизбежные изменения суточной потребности в инсулине в процессе стимуляции суперовуляции за счет дополнительной гормональной нагрузки и выполнить перенос эмбрионов на фоне хорошей компенсации углеводного обмена.
В одном из исследований было показано, что применение микронизированного прогестерона не ассоциировано с повышением уровня гликемии в течение суток и уровня гликированного гемоглобина [35]. У больных СД 1 типа, применявших перорально дидрогестерон, отмечено повышение содержания глюкозы натощак и, в меньшей степени, постпрандиального ее уровня, что явилось основанием для увеличения суммарной дозы инсулина короткого и продленного действия [35].
Другим важным аспектом является то, что часто результатом ЭКО становится многоплодная беременность, которая сама по себе является фактором риска неблагоприятных исходов. В Приказе № 803н оговаривается допустимость переноса в полость матки не более 2 эмбрионов; пациенткам с отягощенным акушерским анамнезом и патологией матки показан селективный перенос 1 эмбриона. У больных СД 1 типа важно исключить возможность развития многоплодной беременности, так как это может значительно повысить риски развития акушерских осложнений во время беременности и родов.
Таким образом, основными условиями к проведению ВРТ у больных СД 1 типа является полноценная прегравидарная подготовка: достижение физиологических показателей гликемии до протокола ЭКО, своевременная и адекватная оценка наличия микрососудистых и макрососудистых осложнений, достижение нормальной массы тела и контроль гипертензивных нарушений разрешенными при беременности препаратами. Использование современных методов лечения у женщин с СД 1 типа, таких как ППИИ, применение аналогов инсулина ультракороткого действия, непрерывного мониторинга гликемии или флэш-мониторинга, делает метод ВРТ эффективным и безопасным и позволяет женщинам с бесплодием и СД 1 типа на фоне совместного наблюдения акушера-гинеколога и эндокринолога, своевременной коррекции гликемии и профилактики осложнений успешно выносить беременность и родить здоровых детей.



